|
考点解析复习专题辅导28.化学平衡
1.复习重点
1. 建立化学平衡的观点.
2. 理解化学平衡的特征.
3. 常识性介绍化学平衡常数.
2.难点聚焦
在化学研究和化工生产中,只考虑化学反应的速率是不够的.
例如:
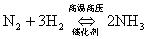
这是一个可逆反应!(正反应的生成物,是逆反应的反应物。)
特点:(二同)同一条件下;同时进行。
显然,可逆反应不能进行到底。(即:反应物不能全部转化为生成物。)
因此,对任一可逆反应来说,都有一个化学反应进行的程度问题。
这就牵涉到化学平衡。
化学平衡主要是研究可逆反应规律的。
如:可逆反应进行的程度,以及各种条件对反应进行的程度的影响等。
(一) 化学平衡的建立:
当我们把蔗糖不断的溶入水中,直至蔗糖不能继续溶解。
此时,所得溶液为蔗糖的饱和溶液。
在此溶液中,继续加入蔗糖,蔗糖不再减少.(温度等其它条件不变时.)
蔗糖真的不能继续溶解了吗?
我们做一个小实验:用一块中间有凹痕的蔗糖,放入蔗糖的饱和溶液中。过一段时间,我们会看到,凹痕不见了。取出蔗糖,小心称量,质量未变!
这是怎么回事呢?
原来,在蔗糖的饱和溶液中,蔗糖并非不再溶解,而是蔗糖溶解的同时,已溶解的蔗糖分子又回到晶体表面。而且,溶解的速率和结晶的速率相同。
所以,在蔗糖的饱和溶液中,加入蔗糖晶体。晶体的质量不会减少,但凹痕却不见了。
这种状态,叫溶解-结晶平衡状态。简称:溶解平衡状态。
显然,溶解平衡状态是动态平衡状态。
可逆反应的情形又是怎样呢?
实验证实:
在一氧化碳和水蒸汽的反应中:
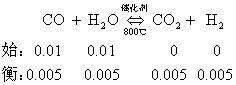
假如温度不变,反应无论进行多长时间,容器里混合气体中各种气体的浓度都不再发生变化.
正反应,逆反应都在继续进行!
只是:
正反应速率==逆反应速率
这种状态,称化学平衡状态.简称:化学平衡.
化学平衡是动态平衡.
当可逆反应达到平衡状态时,正反应和逆反应都仍在继续进行.只是由于在同一瞬间,正反应生成的CO2和H2,的分子数,和逆反应所消耗的CO2和H2,的分子数相等!
即: 正反应速率==逆反应速率
反应混合物中,各组份的浓度不变!
化学平衡:
化学平衡状态,是指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态.
(二) 化学平衡常数:
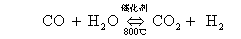
参见表2-1
分析数据可知:
1. 在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,最后都能达到化学平衡.
2. 达到化学平衡后,反应物的浓度之积,比上生成物的浓度之积,是一个常数.---化学平衡常数.
注重:
1.对同一个化学反应来说,温度不变,化学平衡常数不变!(但不一定是1)
2.化学计量数为浓度的指数.
3.K值越大,反应进行的程度越大.反应物的转化率也越大.反之亦然.
3.例题精讲
例1: H2(g) I2(g)  2HI(g)已经达到平衡状态的标志 。 2HI(g)已经达到平衡状态的标志 。
①c(H2)=c(I2)=c(HI)时
②c(H2):c(I2):c(HI)=1:1:2时
③c(H2)、c(I2)、c(HI)不再随时间而改变
④单位时间内生成nmolH2的同时生成2nmolHI
⑤单位时间内生成nmolH2的同时生成nmolI2
⑥反应速率v(H2)=v(I2)= 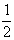 v(HI) v(HI)
⑦一个H-H键断裂的同时有两个H-I键断裂
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
⑾条件一定,混合气体的平均相对分子质量不再变化
[解析]
①浓度相等,不能说明已达到平衡状态;
②浓度之比与平衡状态无必然联系;
③浓度不变,说明已达平衡。注重不要把浓度不变与①、②两种情况混淆;
④“生成nmolH2”指逆反应,“生成2nmolHI”指正反应,且v正=v逆,正确;
⑤“生成nmolH2”、“生成nmolI2”都指逆反应,不能判定;
⑥无论是v正、v逆,用不同物质表示时,一定和化学计量数成正比,与是否达到平衡状态无关。
⑦从微观角度表示v正=v逆,正确;
⑧由于Δν(g) = 0,压强始终不改变;
⑨颜色不变,说明I2(g)浓度不变,可以判定;
⑩由于Δν(g) = 0,体积始终不变,且反应混合物总质量始终不变,密度不变,不能判定是否达到平衡。
⑾反应前后气体的物质的量、质量均不变,所以平均分子量始终不变,不一定达到平衡状态。解答:③④⑦⑨
[点评] 此题从多个角度分析平衡态或不平衡态各种相关物理量的变化情况,有助于加深对平衡特点的理解。
[变式] 若反应为:2NO2(g)  2N2O4(g)呢? 2N2O4(g)呢?
[ 方法提示]
1. 判定是否达到平衡状态式可抓住以下标志:
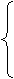 ① ① 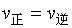
⑴直接标志 ②各组分的m、n不变(单一量)
③通过浓度(或百分含量):各组分的浓度(或百分含量)不变
 ①通过总量:对Δn(g) ①通过总量:对Δn(g) 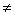 0的反应,n总(或恒温恒压下的V总,恒温恒容下的P总)不变; 0的反应,n总(或恒温恒压下的V总,恒温恒容下的P总)不变;
⑵间接标志 ②通过复合量: 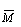 ( ( 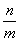 )、ρ( )、ρ( 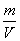 ),需具体分析关系式中上下两项的变化。 ),需具体分析关系式中上下两项的变化。
③其它:如平衡体系颜色等(实际上是有色物质浓度)
例2 把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:
3A(气) B(气) 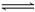 2C(气) 2C(气) 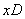 (气)经 (气)经 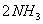 达到平衡,此时生成C为 达到平衡,此时生成C为 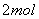 ,测定D的平均反应速率为0.1mol/L•min,下列说法中错误的是 ( ) ,测定D的平均反应速率为0.1mol/L•min,下列说法中错误的是 ( )
A.x = 2 B. B的转化率为20%
C. 平衡时A的浓度为0.8mol/L D. 恒温达平衡时容器内压强为开始时的85%
[解析]
本题是一道有关化学平衡的基础计算题,解题的要害是弄清各量的含义。
因 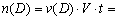 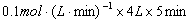 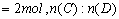
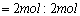 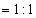 ,所以 ,所以 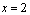 。 。
3A(气) B(气)  2C(气) 2D(气) 2C(气) 2D(气)
起始量(mol) 6 5 0 0
变化量(mol) 3 1 2 2
平衡量(mol) 3 4 2 2
B的转化率为: 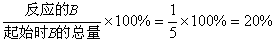
平衡时A的浓度: 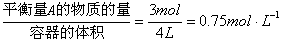
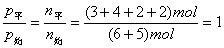 ,所以 ,所以 
[答案]C、D
例3一定条件下,可逆反应A2(g) B2(g)  2 C(g)达到平衡时,各物质的平衡浓度为: 2 C(g)达到平衡时,各物质的平衡浓度为:
c(A2)= 0.5mol/L;c(B2)= 0.1mol/L; c(C)= 1.6mol/L。若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:
(1)a、b应满足的关系是 ;
(2)a的取值范围是 。
[解析] (1)设转化过程中,A2(g)转化浓度为xmol/L,则B2(g)转化浓度也为xmol/L。平衡浓度: a–x = 0.5 b–x = 0.1 则有:a = b 0.4
(2)考虑两种极端情况:①A2、B2为起始物质;②A2、C为起始物质。
A2(g) B2(g)  2 C(g) 2 C(g)
物质的平衡浓度(mol/L) 0.5 0.1 1.6
①A2、B2为起始物质 0.5 0.8 0.1 0.8 0
②A2、C为起始物质 0.5-0.1 0 1.6 0.2
故a的取值范围为0.4≤ b ≤1.3。
[答案] (1)a = b 0.4 (2) 0.4≤ b ≤1.3
[点评]
本题重点考查可逆反应的特点,由此可得B2的取值范围为:0<b≤0.9,C的取值范围为: 0< C ≤1.8。
[ 方法提示]
有关化学平衡的基本计算:
可逆反应mA+nB  pC qD达到平衡时: pC qD达到平衡时:
① 用各物质表示的反应速率之比等于化学方程式中的化学计量数之比.
即:vA.∶vB.∶vC.∶vD.=m∶n∶p∶q
②各物质的变化量(变化浓度)之比等于化学方程式中相应化学计量数之比
③反应物的平衡量(或浓度)=起始量(或浓度)-消耗量(或浓度)
生成物的平衡量(或浓度)=起始量(或浓度) 增加量(或浓度)
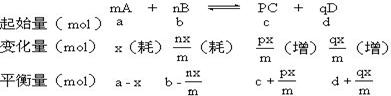

⑤阿伏加德罗定律的两个重要推论

⑥混合气体平均式量的计算(由A、B、C三种气体混合) 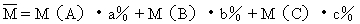
其中M(A)、M(B)、M(C)分别表示A、B、C的相对分子质量;a%、b%、c%分别表示这3种气体的体积(或质量)分数.
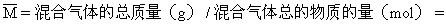 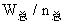
例4:某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应: 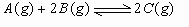 。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时气体C的体积占40%,则下列判定正确的是 ( ) 。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时气体C的体积占40%,则下列判定正确的是 ( )
A. 原混合气体的体积为1.1V
B. 原混合气体的体积为0.9V
C. 反应达到平衡时,气体A消耗了0.2V
D. 反应达到平衡时,气体B消耗了0.2V
[解析] 本题可直接结合反应方程式和题中给出的条件计算,方程式的特征是反应掉的A的量就是总体积的减少量。可由C直接求出气体A消耗了0.2V,所以总体积为1.2V,气体B消耗了0.4V。
[答案] C
[点评] 本题可以改为考查某物质的转化率、体积分数的计算等等。
4.实战演练
一、选择题
1.下列事实不能用勒夏特列原理解释的是: ( )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;
C.在实验室里,可用碳酸钙粉末和稀硫酸制得二氧化碳气体;
D.实验室用排饱和食盐水的方法收集氯气。
2.在一定温度下,一定体积的密闭容器中有如下平衡: H2(g) I2(g)  2HI(g) 2HI(g)
已知H2和I2的起始浓度均为0.10 mol/L时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0.20 mol/L,则平衡时H2的浓度(mol/L)是 ( )
A.0.02 B.0.04 C.0.08 D.0.16
3.一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
2SO2(g) O2(g)  2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( ) 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入1molSO2(g)
B.保持温度和容器内压强不变,充入1molAr(g)
 C.保持温度和容器内压强不变,充入1molO2(g) C.保持温度和容器内压强不变,充入1molO2(g)
D.保持温度和容器内压强不变,充入1molSO3(g)
4.右图曲线a表示放热反应X(g) Y(g) 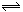 Z(g) M(g) N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( ) Z(g) M(g) N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度 B.加催化剂
C.增大体积 D.加大X的投入量
5.某温度下在密闭容器中发生如下反应: 2M(g) N(g) 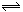 2G(g)若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为 ( ) 2G(g)若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为 ( )
A.20% B.40% C.60% D. 80%
 6.反应aX(g) bY(g) 6.反应aX(g) bY(g) 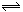 cZ(g);∆H<0(放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判定正确的是:( ) cZ(g);∆H<0(放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判定正确的是:( )
A.T1<T2,P1<P2,a b<c
B.T1<T2,P1>P2, a b<c
C.T1>T2,P1>P2, a b>c
D.T1>T2,P1<P2 ,a b>c
7.在一定温度下,密闭容器中可逆反应A(g) 3B(g) 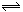 2C(g)达到平衡的标志是 ( ) 2C(g)达到平衡的标志是 ( )
A.C的生成速率与B的反应速率相等 B.单位时间内生成n molA,同时生成3n molB
C.A、B、C的浓度不再变化 D.A、B、C的浓度之比为1:3:2
8.在容积固定的密闭容器中存在如下反应: A(g) 3B(g) 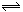 2C(g) 该反应正反应为放热反应。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判定一定错误的是 ( ) 2C(g) 该反应正反应为放热反应。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判定一定错误的是 ( )
A.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
B.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
C.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
D.图I研究的是压强对反应的影响,且乙的压强较高.
9.体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 O2  2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率 ( ) 2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率 ( )
A.等于P% B.小于P% C.大于P% D.无法判定
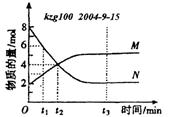 10.在一定温度下,容器内某—反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是 ( ) 10.在一定温度下,容器内某—反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是 ( )
A.反应的化学方程式为:2M 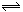 N N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
11.压强变化不会使下列化学反应的平衡发生移动的是 ( )
A.H2(g) I2(g) 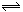 2HI(g) B.3H2(g) N2(g) 2HI(g) B.3H2(g) N2(g) 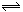 2NH3(s) 2NH3(s)
C.2SO2(g) O2(g) 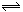 2SO3(g) D.C(s) CO2(g) 2SO3(g) D.C(s) CO2(g) 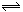 2CO(g) 2CO(g)
12.在两个恒容容器中有平衡体系:A(g) 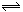 2B(g)和2A(g) 2B(g)和2A(g) 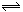 B(g),X1和X2分别是A转化率。在温度不变情况下,均增加A的物质的量,下列判定正确的是: ( ) B(g),X1和X2分别是A转化率。在温度不变情况下,均增加A的物质的量,下列判定正确的是: ( )
A.X1降低,X2增大 B.X1、X2均降低
C.X1增大,X2降低 D.X1、X2均增大
13.在一定条件下,向5L密闭容器中充入2 molA气体和1 molB气体,发生可逆反应:2A(g) B(g) 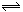 2C(g),达到平衡时容器内B的物质的量浓度为0.1 moL/L,则A的转化率为 ( ) 2C(g),达到平衡时容器内B的物质的量浓度为0.1 moL/L,则A的转化率为 ( )
A.67% B.50% C.90% D.10%
14.在一定条件下发生反应:2A(g) 2B(g)  xC(g) 2D(g),在2L密闭容器中,把4molA和2 molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L·min),下列说法正确的是: ( ) xC(g) 2D(g),在2L密闭容器中,把4molA和2 molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L·min),下列说法正确的是: ( )
A.B的转化率是20% B.平衡时A的物质的量为2.8mol
C.平衡时容器内气体压强比原来减小 D.x = 4
15.在下列平衡2CrO42-(黄色) 2H  Cr2O72-(橙红色) H2O中,溶液介于黄和橙红色之间,今欲增加溶液的橙红色,则要在溶液中加入 ( ) Cr2O72-(橙红色) H2O中,溶液介于黄和橙红色之间,今欲增加溶液的橙红色,则要在溶液中加入 ( )
A.H B.OH- C.K D.H2O
第Ⅱ卷(非选择题,共40分)
二、填空题(共24分。把正确答案填写在题中的横线上,或按题目要求作答。)
16. I. 合成氨工业对化学的国防工业具有重要意义。写出氨的两种重要用途
。
II. 实验室制备氨气,下列方法中适宜选用的是 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
III. 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
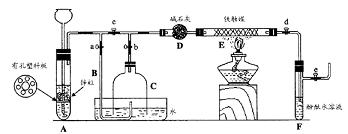
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。② 关闭弹簧夹c,放下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。
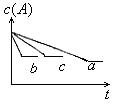 17.反应A(g) B(g) 17.反应A(g) B(g) 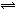 C(g)在密闭容器中进行,△H<0(放热反应)。若存在三种情况:①200℃,无催化剂;②500℃无催化剂;③500℃有催化剂;情况①是曲线 ,情况②是曲线 ,情况③是曲线 。三、计算题(10分) C(g)在密闭容器中进行,△H<0(放热反应)。若存在三种情况:①200℃,无催化剂;②500℃无催化剂;③500℃有催化剂;情况①是曲线 ,情况②是曲线 ,情况③是曲线 。三、计算题(10分)
18.在固定容器的密闭容器中,有可逆反应nA(g) mB(g) 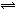 pC(g)处于平衡状态(已知n m>p,△H>0既吸热反应)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均式量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。 pC(g)处于平衡状态(已知n m>p,△H>0既吸热反应)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均式量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。
19.恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) 3 H2(g) 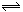 2NH3(g) 2NH3(g)
(1)某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值。
(2)若已知反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
参考答案
一、选择题 |
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | |
答案 |
C |
B |
D |
B |
C |
C |
C |
C |
B |
D | |
题号 |
11 |
12 |
13 |
14 |
15 |
| |
答案 |
A |
A |
B |
D |
A |
| |