| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(1)写出A~F物质的化学式。 A: ,B: ,C: D: ,E: ,F: (2)写出下列反应的离子方程式。 A与D反应: C与E反应: B与F反应: 9、有一瓶澄清的溶液,其中可能含有NH4 、K 、Na 、Mg2 、Ba2 、Al3 、Fe3 、Cl-、I-、 NO3-、CO32-、SO42-中的几种。取该溶液进行以下实验: (1)用pH试纸检验,表明溶液呈强酸性。排除 离子的存在。 (2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色。排除 离子存在。 (3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。则可排除 离子的存在。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。 (4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。证实 离子存在,又排除 离子存在。 (5)根据上述实验事实确定:①该溶液中肯定存在的离子是 ;②肯定不存在的离子是 ;③还不能确定是否存在的离子是 。 10、已知下列转化关系中的中学化学常见物质A、B、C、D、E中均含有同一种元素,
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A—E共同含有甲 元素。可知:A的化学式为 ,E的化学式为 。当小心加热A与E化合的生成物F时,可能得到一种无色无味的气体G和一种无色无味的液体H,写出F分解生成的G H的化学方程式 。 (2)当A与E反应生成B和C时,则A—E共同含有乙元素。此时:B为淡黄色固体,C气体易液化,常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是 ,在A—E各物质中,一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化 合,生成物的化学式可表示为 (写成化合物、复合物或氧化物均可)。 11、已知A—L所代表的物质(或溶液中的溶质)都是中学化学课本里学过的物质。通常状况下,A、B均是淡黄色固体,D是单质气体,E是无色无味气体,K是不溶于水的酸。反应①一③是化学工业生产某重要产品的三步反应,反应④是工业生产普通玻璃的反应之一。一定条件下,各物质间的相互转化关系如图所示(反应时加入或生成的水均没标出)
(1)写出下列物质的化学式:B ;D的同素异形体 (2)写出A的电子式 ;E的结构式 (3)指出反应①、②、③是吸热反应,还是放热反应 ① ② ③ (4)完成下列反应方程式 反应⑤的离子方程式: 反应④的化学方程式:
(1)丙的名称是 ;C的化学式是 ;X属 晶体。 (2)A D→C的反应属于下列何种反应类型(填序号) 。 A.化合反应 B.氧化还原反应 C.非氧化还原反应 D.离子反。 A.化合反应 B.氧化还原反应 C.非氧化还原反应 D.离子反应 (3)工业生产中,将D转化为E的反应条件是 。
。 (5)若用如图装置来证实A和H2O的反应: ①是放热反应,②生成了丙。简单合理的实验 操作是: ① ; ② 。 13、(1)A 、B 、C-、D、E代表5种微粒(分子或离子),它们分别含10个电子,已知它们有 如下转化关系:A C-=D E B C-=2D ①A 的电子式为 ;E分子的空间构型为 。 ②C-、D、E3种微粒结合质子(H )的能力由强到弱的顺序为(用微粒的化学式表示) ;其理由是(用两个离子方程式表示) , 。 14、已知A~K所代表的各物质都是中学化学里常见的物质,且I是具有磁性的物质,D和K都具有两性。一定条件下,各物质间的相互反应转化关系如下图所示:
请回答: (1)写出有关物质化学式:D是 ,H是 。 (2)写出下列反应的方程式: ①化合物G的溶液不呈中性,其原因用离子方程式表示为 , ②C+F 15、如下图所示,A、B、C、D、E五种物质的相互转化关系
请回答: (1)若A通常状态下为固态单质,A→E分别为(写化学式)A ;B ; C ;D ;E 。 (2)若A通常状态下为气态单质,则A→E分别为(写化学式)A ;B ;C ;D ;E 。 (3)写出(2)中物质间转化的离子方程式E→C
回答下列问题: (1)物质的分子式:A 、B 、C 、D 、 E 、F 。 (2)写E→F的离子方程式 。 17、A、B、C为三种不溶于水,透明、坚硬的固体。A在氧气中完全燃烧只得到一种无色、无臭、密度为氧气密度的1.375倍(标准状况)的气体。B的粉末易溶于热的苛性钠溶液,向此溶液中加入过量盐酸时,析出一种不溶于水,酸性比碳酸还弱的酸。将B与石灰石,纯碱按一定比例混合高温溶融后得C。C在高温下能软化,但无固定的熔点。根据以上事实回答: (1)A、B、C的名称:A B C (2)写出有关化学反应的方程式 B和苛性钠反应: 。 B→C的主要的反应: 。 18、已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。 ①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。 ②常温下将气体D通入水中发生反应,生成C和E; ③工业上以A、空气和水为原料,通过催化氧化法制取E; 请回答以下问题: (1)B分子中含有化学键为 (写名称),A的分子式为 ,A分子的空间构型是 。 (2)写出②中涉及反应的化学方程式 。 (3)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式 。 (4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式 。 19、某新型无机材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨损、耐腐蚀、耐高温、抗氧化的特性。它是用中学化学中的常见物质为原料来生产的。其生产流程如下图所示,其中虚线框内的转化是为了探究C的组成而设的。已知C的相对分子质量为NH3的10倍,分子空间构型与甲烷相同。G、F、H为难溶于水的白色固体,且H为高性能通讯材料光导纤维的主要原料。图中除M、K(均含A元素)外,其它字母代表的均为中学化学中常见的物质。
回答下列问题: (1)K可能属于的晶体类型是________________。 (2)写出化学式:单质B__________,化合物F____________。 (3)写出下列反应的离子方程式: 反应⑤:___________________________________________ 反应⑥:___________________________________________ (4)反应④的化学方程式为:________________________ 20、A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。 请填写下列空白: (1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第_______周期、第_______族 ; (2)写出反应①的化学方程式___________ _________; (3)写出反应④的离子方程式_____________ _______; 阳极:_______________ _____ 阴极:____________ __________ 21、 ①A++C- D+E↑ ②B++C-→2D ③E+B+→A++D 据此,回答下列问题: ⑴A+、B+、C-的化学式依次为 、 、 。 ⑵E的电子式为 ,它是 (填“极性”或“非极性”)分子,它的空间构型为 (用文字表示)。 ⑶由①②③式反应可知,C-、D、E 三种微粒结合质子(H+)能力由强到弱的顺序是(用微粒的化学式表示) 。
试回答: ⑴写出化学式 ,X ,E ; ⑵写出离子方程式:A→X ; C→D 。 ⑶A+E反应的化学方程式为: 。
(1)丁在甲和X同时存在的条件下,可发生电化腐蚀,写出正极上的电极反应式: 。 (2)将少量W的饱和溶液滴入热的X中,反应的化学方程式是 。 (3)若Z、W两溶液的pH均等于5,则两溶液中由水电离出的H 的物质的量浓度之比为 。 (4)已知5.6L(标准状况)气体丙在甲中完全燃烧放出热量为71.45kJ,则能正确表示丙燃烧热的热化学方程式为 。
(1)各物质的化学式为: B. , D. , (2)写出A→C的化学方程式和E→C的离子方程式: A→C: E→C: 25、A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶水得黄棕色溶液。这九种物质间反应的转化关系如图所示
(1)写出四种单质的化学式 A_________ B__________ C______ D________ (2)写出E+F→H+I的离子方程式
26、以下三例是常见的化学实验
回答下列问题: (1)每例中均可用前后两个化学反应方程式来说明变化的现象,试用简要文字,说明这两个反应间的关系 _______________________________________________________ (2)每例中若要保证后一个反应发生,必须具备的条件是什么? _______________________________________________________ _______________________________________________________ (3)将各例中前后两个反应方程式叠加,写出一个总的反应方程式。 ①___________________________________________________ ②___________________________________________________ ③___________________________________________________ 27、物质A—H有下图所示转化关系(部分反应物、生成物没有列出)。其中,B的浓溶液与单质X在加热时才能发生反应①,B的稀溶液与足量X发生反应②,向C溶液中滴入KSCN溶液呈红色。
试填写下列空白: (1)晶体A是(化学式)________________________。 (2)反应②的离子方程式:______________________。 (3)根据图示信息判定,足量B的浓溶液与单质X共热时能否产生E,说明理由(写出化学方程式回答):____________________。 (4)在反应⑤中,若生成物G与H的物质的量之比为4∶1,写出F溶液与Na2O2反应的化学方程式:_______________________。 28、X、Y、Z、W 4种元素都位于短周期, 且原子序数X<Y<Z<W, X原子与Y原子的最外层电子数的和跟Z原子最外层电子数相等, X原子半径为其阳离子半径的约 (1)
29、A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物。这些单质和化合物之间存在如右图所示的关系:据此判定: (1) 若单质A是________,则单质B、C分别为________、________。 (2) 若单质A是________,则单质B、C分别为________、________。 (3) 若单质A是________,则单质B、C分别为________、________。 30、 (1)化学科学家常用"等电子体"来猜测不同物质的结构,例如CH4与NH4 有相同的电子及空间构形。依此原理将下表中空格填出相应的化学式
(2)工业上生产尾气中的H2S要经过处理成硫单质后方能排放,以防止大气污染,富玛克斯法治理硫化氢的方法和步骤如下: ①用2%~3%的Na2CO3溶液做吸收剂生成2种酸式盐; ②再加入一种RNO(R表示芳香族有机物的基)与①生成的一种酸式盐的水溶液反应生成硫、碱和R-NHOH; ③第②步生成的碱在溶液中与另一种酸式盐反应生成正盐; ④R-NHOH与空气中的氧发生反应又得到RNO。 (3)写出上述4步反应的化学方程式: ①___________________________ ②___________________________ ③___________________________ ④___________________________ 31、某厂废液中含有大量
(1)写出下列物质的化学式: 试剂x_______________、试剂z_______________。 晶体E_______________、固体G_______________ (2)写出下列反应的离子方程式: 沉淀A 试剂y:______________________________ 滤液D 过量 32、已知某些金属氧化物跟熔融烧碱反应可生成盐。根据下图所示化学反应回答下列问题。
(1)单质F的化学式为___________________________。 (2)写出下列反应的离子方程式 C L—→F E H L(过量)—→I (3)C L—→E F,若L改用浓酸,则不能选用的浓酸是_________________。 33、下列图式中A——N代表的各物质均为中学化学中常见物质,它们在一定条件下有如下转化关系:
试写出有关反应的化学方程式(有机物写结构简式) (1)由D制取H:______。 (2)Ⅰ与石灰水:_______。
(4)E与J:_______。 34、(1)有原子序数依次增大的A、B、C、D、E5种短周期元素,它们可两两组合成甲、乙、丙、丁4种化合物。各种化合物中原子个数比关系如下表:
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,C的化学性质活泼;D和E则位于同一周期,且D和E的原子序数之和为30。已知乙的相对分子质量小于甲。请回答: ①写出甲、乙、丙、丁的化学式: 甲:___乙:______丙:_____丁:_______。 ②丙的水溶液与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关的离子方程式是_________。 (2)已知X和Y均为短周期元素,单质X在空气中点燃,能发出刺眼的白光。在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如框图所示),已知气体G与氢气之密度比约为8.5。
①组成单质X和Y的元素分别属第____族和第____族。 ②化合物Z的化学式为____________。 ③每生成1mol的气体G,同时应得到___mol的沉淀P。 35、A,B,C,D四种化合物,它们的化学式都符合RX2型。组成这四种化合物的元素的原子序数都不超过20。构成这四种化合物的化学键为:A,B只有共价键,A熔点很低,B却熔点很高。C只有离子键,D既有离子键又有共价键。 A和C都难与各种氢卤酸反应;B、C都难深于水,D却与水剧烈反应。 A能在空气里烯烧,B、C、D则不能。 B可与某种氢卤酸反应,所产生的气体不能燃烧; D可与各种氢卤酸反应,所产生的气体极易燃烧。 根据上述进行判定: (1). 写出四种化合物的分子式: A______________; B_____________; C_____________; D_____________。 (2). 写出有关化学反应方程式: a. A在空气中燃烧: _____________________________________________, b. B与氢卤酸反应: _____________________________________________, c. C与水反应: _________________________________________________。 36、某小型化工厂生产皓矾,结晶前的酸性饱和溶液中含有少量的Cu2 、Fe3 、Fe2 等杂质离子。为了除去杂质,获得纯净的皓矾晶体,该工厂设计如下工艺流程:
已知:开始生成氢氧化物沉淀到沉淀完全的pH值范围分别为: Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0 试回答下列有关问题: (1)加入的试剂①应是 ;主要的离子方程式有: 。 (2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。 (3)加入试剂③的目的是 。 37、甲、乙是两种常见短周期元素的单质,其有关化合物性质如图,其中C为白色 (1)若D为酸性气体,则A的化学式为____________. (2)若D为碱性气体,则A H2O→C D化学方程式:_____________________. (3)若由两种元素组成的化合物M发生水解反应只生成两种酸N和P,则下列有关说法中,正确的是_______. A.M可能由两种非金属元素组成 B.N、P均一定为一元酸 C.M一定含有金属元素 D.此反应可能为氧化还原反应 E.生成物中无氧酸、含氧酸并存 39、有A、B、C、D、E五种主族元素,原子序数依次增大,且均不超过36。已知:B、C、D同周期,A与D同主族,C与E同主族;A原子最外层电子数为内层电子数的3倍,C原子的内层电子总数为最外层电子的2倍,B在同周期元素中原子半径最大。 40、从化合物A出发,发生下图所示的一系列变化:
已知:A是由三种短周期元素组成的固体化合物,C为浅黄色固体,D、H为无色气体,E为黑色固体,G为浅绿色溶液,E为棕黄色溶液,X为液体,Y为某金属,试回答: (1)写出有关物质的分子式:A是__________E是__________X是__________ (2)写出有关反应的离子方程式: ①______________________ ⑤______________________ ⑥______________________ 41、下图是中学化学中常见的物质间化学反应关系的图示,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水、也难溶于稀酸的白色固体。 \s (1)写出化学式:A——;B——。 (2)写出下列反应的离子方程式: [1]C [2] [3] 42、江苏省东临大海,利用海水等可制得多种化工产品。下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质。
试填写下列空白: ⑴N的化学式为: ; ⑵写出反应①的化学方程式: ; ⑶由K溶液经如何处理才能制得N? 。 43、A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol-1,甲元素的原子最外层电子数与K层相等,乙元素的氢化物水溶液显碱性。C为单质,其原子半径在周期表中最小。D为气体,其密度为相同条件下空气密度的1.103倍。K为乙元素的单质。在适当的条件下,它们之间有如下图所示的转化关系:
试填写下列空白: ⑴ 甲元素的单质在空气中燃烧可得到_____________(填化学式)。 K分子的结构式为___________ ⑵ 完成下列有关反应的化学方程式 E D E CuO: ___________________________ ⑶ E与G在一定条件下若能反应,写出化学方程式;若不能,则说明理由。 ____________________________________________________ 44、W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1:1,Y原子最外层s电子与p电子数之比为1:1,Z原子核外电子中p电子数比Y原子多2个。 (1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式: (2)W、X元素的最高价氧化物对应水化物的碱性强弱为 < (用分子式表示)。 (3)这四种元素原子半径的大小为 > > > (填元素符号) 45、a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码
| a
| b
| c
| d
| e
| f
| g
| 原子核数
| 单核
| 单核
| 双核
| 多核
| 单核
| 多核
| 多核
| 带电荷数 (单位电荷)
| 0
| 1
| 1-
| 0
| 2
| 1
| 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示) (3)d溶于水的电离方程式
(4)g微粒所构成的晶体类型属 (5)c微粒是 ,f微粒是
(用化学式表示)
答案
1、(1)A:HCl B:Cl2 C:H2 D:CaCl2和Ca(ClO)2
(2)2Cl2十2Ca(OH)2===Ca(ClO)2十CaCl2 2H2O,漂白粉Ca(ClO)2
Ca(ClO)2 CO2 H2O===CaCO3↓ 2HClO
2、(1)Na2O2 (2) C2H2 (3) CO2 OH ![]() =HCO
=HCO ![]()
(4) Na2CO3 (5) 1:5
3、1)Al2S3、S (2)①AlO2- 4H ═Al3 2H2O ②3AlO2- Al3 6H2O═4Al(OH)3↓
4、(1)S 接触室 (2)NO2 ①动力设备材料 化学平衡 化学反应速率等 ②反应速率 化学平衡 催化剂活性等 (3) (4)CH4 C 2H2 2C O2(不足) 2CO
5、(1) ![]() 离子键、非极性键
离子键、非极性键
(2)NaHSO3 NaHSO4 H++HSO ![]() ====SO2↑+ H2O
====SO2↑+ H2O
(3)负 2H2 +4OH— —4e-====4H2O
正 O2 +2H2O +4e-====4OH-
6、(1)Fe—2e-====Fe2+ O2+2H2O+4e-====4OH-(4分)
(2)FeCl3 +3H2O ![]() Fe(OH)3(胶体)+3HCl(2分)
Fe(OH)3(胶体)+3HCl(2分)
(3)Fe3O4+8H+====Fe2++Fe3++4H2O(2分)
(4)3∶ 4(2分)
7、(1) ![]() (2)过滤
(2)过滤
(3) ![]()
8、(1)A:HCl B:MgSO4 C:AgNO3 D:(NH4)2CO3 E:BaCl2 F:NaOH
(2)CO32- 2H =H2O CO2↑ Ag Cl-=AgCl↓ Mg2 2OH-=Mg(OH)2↓
9、(1)CO32-
(2)NO3-、Fe3
(3)Mg2 、Al3 、Fe3 (也可不写Fe3 )
(4)Ba2 SO42-
(5)①Ba2 、I-、NH4
②Mg2 、Al3 、Fe3 、CO32-、SO42-、、NO3-
③K 、Na 、Cl-
10、(1)NH3,HNO3; NH4NO3 N2O 2H2O
(2)SO3;AB;H2S2O7或H2SO4·SO3或2SO3·H2O
11、

(3)①放热反应②放热反应③放热反应
(4)2Fe3+ S02十2H2O=SO42-十2Fe2++4H-
![]()
(5)0.2 mol
12、(1)氧气;Na2SO4;离子。
(2)A、B。
(3)400℃~500℃,催化剂。
(4)2Na2O2 2H2O=4NaOH O2↑。
①将q导管口插入水面下,打开分液漏斗活塞,反应后,q导管口有气泡冒出则证实反应放热。 ②打开分液漏斗活塞,使之反应,然后用带火星的木条置于p管口,木条复燃则证实有O2生成。(
|
|
H
|
(2)①碳。 ②2KOCN 4KOH 3Cl2=2CO2 N2 6KCl 2H2O。
③35.5。
14、(1)Al2O3、H2
(2)①Al3++3H2O ![]() Al(OH)3+ 3H+
Al(OH)3+ 3H+
②3Fe+4H2O ![]() Fe3O4+4H2
Fe3O4+4H2
15、(1)S、H2S、SO2、SO3、H2SO4 (2)N2、NH3、NO、NO2、HNO3
(3)3Cu 8H 2NO3— 3Cu2 2NO↑ 4H2O
16、(1)(NH4)2SO3(或NH4HSO3); (NH4)2SO4(或NH4HSO4); SO2; NH3; K2SO3; K2SO4
(2)SO32— Br2 H2O SO42— 2Br— 2H
|
|
Na2CO3 SiO2 Na2SiO3 CO2↑ CaCO3 SiO2 CaSiO3 CO2↑
18、(1)共价键 NH3 三角锥形 (2)3NO2 H2O=2HNO3 NO
(3) ![]() N2(g)
N2(g) ![]() H2(g)
H2(g) NH3(g);△H=-46.2kJ·mol—1 (4)8NH3 Cl2=N2 6NH4Cl
19(1)原于晶体
(2) ![]()
![]()
(3) ![]()
![]()
(4) ![]()
20⑴第四面期、第Ⅷ族
⑵8Al+3Fe3O4 ![]() 4Al2O3+9Fe
4Al2O3+9Fe
⑶ 2Al+2OH-+2H2O=2AlO2-+3H2↑
⑷阳极:3O22--6e-=3O2↑;阴极:2Al3 +6e-=2Al
(5)①②
21. ⑴A+、B+、C- 依次为NH4+、H3O+、OH- ;⑵ ;极性 ;三角锥
⑶OH->NH3>H2O
22. ⑴ X Cl2 Y H2O2
![]()
![]() ⑵ MnO2 + 4H++ 2Cl- Mn2++Cl2↑+2H2O
⑵ MnO2 + 4H++ 2Cl- Mn2++Cl2↑+2H2O
Al2O3 +6H+=2Al3++3H2O ⑶ 2H2O2 2 H2O +O2↑
23、(1)O2 2H2O 4e- 4OH-
(2)FeCl3 3H2O Fe(OH)3(胶体) 3HCl
(3)1:104(2分)H2(g) ![]() O2(g)
O2(g) H2O(I);△H=-285.8kJ·mol-1
24、(1)B NO2 D NH3
(2) ![]() 3Cu 8H 2NO3-= 3Cu2 2NO↑ 4H2O
3Cu 8H 2NO3-= 3Cu2 2NO↑ 4H2O
25、(1)A.H2,B.Cl2,C.Fe,D.S,
(2)FeS 2H =Fe2 H2S↑
(3)2FeCl3 H2S=2FeCl2 S↓ 2HCl
26、(1)①两个反应是连续进行的 ②两个反应一前一后 ③前者的生成物是后者的反应物
(2)前一反应的两个反应物中,必有某个反应物过量
(3)①2CO2 Ca(OH)2=Ca(HCO3)2
②2HCl Na2CO3=2NaCl H2O CO2↑
③4NaOH AlCl3=NaAlO2 3NaCl 2H2O
27、1)NaNO3
(2)3Fe 2NO3 8H ![]() 3Fe2 2NO↑ 4H2O
3Fe2 2NO↑ 4H2O
(或:Fe NO3- 4H ![]() Fe3 NO↑ 2H2O2Fe3 Fe
Fe3 NO↑ 2H2O2Fe3 Fe ![]() 3Fe2 )
3Fe2 )
(3)由反应④:NO 2HNO3(浓) ![]() 3NO2 H2O 可知在浓HNO3中不能生成NO
3NO2 H2O 可知在浓HNO3中不能生成NO
(4)4Fe(NO3)2 4Na2O2 6H2O ![]() 4Fe(OH)3↓ O2↑ 8NaNO3
4Fe(OH)3↓ O2↑ 8NaNO3
28、 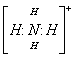 , 乙二酸铵,
, 乙二酸铵, ![]()
29、(1)O2、S、H2(3分)(2)Cl2、S、H2(3分)(3)Mg、C、O2
30、(1)
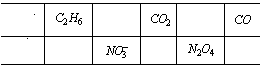
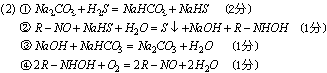
31、(1) ![]()
![]() (葡萄糖或
(葡萄糖或 ![]() 等含醛基的有机物)
等含醛基的有机物)
![]()
![]()
(2) ![]()
![]()
32、(1) ![]() (2)
(2) ![]() ↑;
↑;
![]() (3) 浓
(3) 浓 ![]() 、浓
、浓 ![]()
33、(1)NaCl NH3 CO2 H2O==NaHCO3↓ NH4Cl
(2)Na2CO3 Ca(OH)2==CaCO3↓ 2NaOH
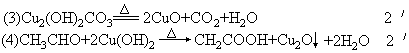
34、(1)①H2O2;C2H4;AlCl3;CCl4
![]()
(2)①Ⅱ A Ⅴ A 1′②Mg3N2 1′③1.5
35、(1).〖解答〗
A:CS2 B:SiO2 C: CaF2 D: CaC2
(2).〖解答〗
a. CS2 3O2 = CO2 2SO2
b. SiO2 4HF = SiF4↑ 2H2O
c. CaC2 2HCl = CaCl2 C2H2 ↑
36、(1)Zn(1分);Zn Cu2 = Cu Zn2 ;Zn 2Fe3 = 2Fe2 Zn2 (2分)
(2)H2O2(1分);当氧化剂,又不带入其他杂质(2分)
(3)调节溶液的pH值(1分)
37、(1)AL2S3;(2)Mg3N2+6H2O=3Mg(OH)2+2NH3;(3)A·E(此项只同水解有关)。
38、A-NH4HCO3 B-CaC2 C-CaCO3 D-C2H2 E-NH3
F-CO2 G-Ca(HCO3)2
39、分析 A最外层电子数为内层的3倍,所以A为O,同理C为P,B为Na,D为S,E为As
答案 ![]()
(2)As2O3+6HCl ![]() 2AsCl3+3H2O
2AsCl3+3H2O
As2O3+6NaOH ![]() 2Na3AsO3+3H2O
2Na3AsO3+3H2O
(3)3H2S+2AsCl3 ![]() As2S3+6HCl
As2S3+6HCl
40、(1)A是Na2S2O3 E是FeS X是HCl
(2)①S2O32- 2H ===S↓ SO2 H2O
⑤2Fe3 H2S===2Fe2 S↓ 2H
⑥SO2 2Fe3 2H2O====SO42- 2Fe2 4H
41、(1) A为Na ![]() SiO
SiO ![]() (2分)B为BaC
(2分)B为BaC ![]() 。
。
(2) [1] ![]()
[2] ![]()
[3] ![]()
42、⑴Mg ; ⑵NaCl(饱和) NH3 CO2 H2O==NaHCO3↓ NH4Cl ;
⑶MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁
43、⑴ MgO、Mg3N2、C N≡N
⑵ 4NH3 5O2 ![]() 4NO 6H2O
4NO 6H2O
2NH3 3CuO ![]() N2 3Cu 3H2O
N2 3Cu 3H2O
⑶ 4NH3 6NO = 5N2 6H2O
44、(1)2Mg CO2 ![]() 2MgO C (2)Mg(OH)2<NaOH (3)Na>Mg>C>O
2MgO C (2)Mg(OH)2<NaOH (3)Na>Mg>C>O
45、(1)1s22S22p6 (2)NaOH>Mg(OH)2 `(3)NH3 H2O≒NH3·H2O≒NH ![]() OH- (4)分子晶体
OH- (4)分子晶体
| |