本卷满分100分,考试时间100分钟
原子量:Fe:56 Na:23 S:32 Cu:64 H:1 O:16
选择题答题卡
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
一.选择题(单选题,每小题3分,共45分).
1.下列化合物中阳离子与阴离子的半径之比最小的是( )
A.CsI B.LiI C.CsF D.LiF
2.下列各组物质中的两种,互为同位素的是( )
A.Na2O和Na2O2 B.白磷和红磷
C.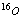 和
和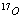 D.
D.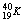 和
和
3.将CuSO4·5H2O放入浓H2SO4中,则颜色变为( )
A.蓝色 B.黑色 C.白色 D.不变
4.某元素的原子最外层只有一个电子,它跟卤素相结合时,可形成的化学键( )
A.一定是共价键
B. 一定是离子键
C.可能是离子键,也可能是共价键
D.上述说法都不对
5.下列叙述中能说明R元素是氮族(ⅴA族)元素的是 ( )
A.R元素的氢化物化学式为RH3
B.R元素的最高化合价为+5价
C.R的氧化物可形成化学式为HRO3的含氧酸
D.其含氧酸为一元强酸
6.下列各组离子能在碱性溶液中大量共存的是 ( )
A.H+、Na+、Cl-、SO42- B.K+、Na+、SO42-、SO32-
C.Cu2+、Cl-、K+、S2- D.Ba2+、K+、SO32-、HSO3-
7.下列离子方程式书写正确的是 ( )
A.烧碱溶液中通入少量SO2 SO2+2OH-=SO32-+H2O
B.氢氧化钡溶液与稀硫酸混合 Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.硫化亚铁与稀硫酸反应 S2-+2H+=H2S↑
D.硫化氢通入硫酸铜溶液中 S2-+Cu2+=CuS↓
8.检验未知溶液中是否含有SO42-,下列操作最合理的是( )
A.加入硝酸酸化了的Ba(NO3)2溶液
B.先加入硝酸酸化,再加Ba(NO3)2溶液
C.先加入盐酸酸化,再加BaCl2溶液
D.加入盐酸酸化了的BaCl2溶液
9.某元素位于周期表的ⅳA族,它是良好的半导体材料,其金属性比非金属性强,所以通常认为它是金属。此元素可能是( )
A.Si B.Ge C.Sn D.Pd
10.某元素离子Am-的核内有n个中子,核外有x个电子。该元素原子的质量数为
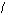 A.x-m+n B.x+m+n C.m+n-x D.x-n+m ( )
A.x-m+n B.x+m+n C.m+n-x D.x-n+m ( )
11.铜有两种核素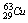 和
和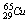 ,铜的原子量为63.5,估算
,铜的原子量为63.5,估算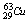 的原子个数百分比为
的原子个数百分比为
A.20% B.50% C.75% D.66.7% ( )
12.某种Na2S、Na2SO3、Na2SO4的混合物,测得其中含硫24%,则混合物中氧元素的质量分数为 ( )
A.41.5% B.45% C.38% D39.5%
13.X、Y两元素都是非金属元素,与金属R反应时生成RX2和RY2,如果X的原子半径比Y的大,下列说法正确的是( )
A.X的最高价氧化物对应的水化物酸性比Y的弱
B.X的金属性比Y的弱
C.X的阴离子比Y的阴离子还原性弱
D.X的气态氢化物比Y的稳定
14.第四周期某主族元素的原子,它的最外层电子层上有两个电子,下列关于此元素的叙述正确的是( )
A.原子半径比钾的原子半径小 B.氯化物难溶于水
C.原子半径比钾的原子半径大 D.碳酸盐易溶于水
15.在加热条件下,一定量浓硫酸与mg铜充分反应后得到标况下nLSO2气体,则反应中被还原的H2SO4为( )
A.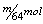 B.
B.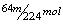 C.
C.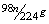 D.
D.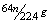
二.实验题(21分)
16.(15分)
(提示:酸性高锰酸钾溶液可把SO2氧化成H2SO4)
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是 ;
(2)试用上图所示各装置设计一个实验,来验证上述反应所产生的各种产物.
这些装置的连接顺序(气流从左至右的方向)是(填装置的编号): →
→ → .(每空0.5分)
(3)实验时可观察到装置①中A瓶溶液 ,C瓶溶液 .A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用
(4)装置②中所加的固体药品是 ,可验证的产物是 .
(5)装置③中所加溶液是 ,可验证的产物是 ,发生反应的离子方程式是 .
17.(6分)某无色混合气体可能含有CO2、CO、N2、H2O(g)、H2中的一种或几种,依次进行以下处理(假设每次处理均反应完全):①通过碱石灰时,气体体积缩小;②通过炽热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为兰色;④通过澄清石灰水时,溶液变浑浊,气体被完全吸收。由此可以确定原混合气体中:一定含有 ;可能含有 ;一定不含 (填化学式)。
三.填空题(18分)
18.(9分)人体缺碘会影响正常的生命活动,为提高人体素质,食盐补碘已引起人们的重视.
(1)碘在元素周期表中位于 周期 族, 色,易升华,碘的酒精溶液称为 .
(2)碘是人和动物体内合成下列哪种激素的原料( )
A.生长激素 B.胰岛素 C.甲状腺激素 D.性激素
(3)成年人体内缺碘易产生的病症是( )
A.甲状腺机能亢进症 B.地方性呆小症
C.侏儒症 D.地方性甲状腺肿大
(4)为防止上述现象产生,1996年我国政府以国家标准的方式规定在食盐中加
(A.KIO3 B.KI C.I2 D.NaI) (填字母)来补充碘摄入的不足.添加剂中不能使用KI的原因可能是( )
A.KI口感苦涩 B.KI有毒
C.KI在储运过程中易变质 D.KI价格昂贵
(5)已知IO3-可与I-发生反应:IO3-+5I-+6H+=3I2+3H2O
根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-
可供选用的物质有:①自来水;②蓝色石蕊试纸;③KI淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒.进行上述实验时必须使用的物质是( )
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
19.(9分)今有A、B、C、D四种短周期元素,它们的核电荷数依次增大.A和C,B和D分别是同主族元素,B、D两元素的质子数之和是A、C两元素的质子数之和的两倍.这四种元素中有一种元素的单质易溶解于CS2溶剂中。则四种元素是A 、B 、C 、D 。A和D两元素可由 键形成____化合物,该化合物的电子式为 写出两种均含四种元素的化合物相互反应的化学方程式: (2分)。
四.计算题(16分)
20(8分)有两种气体单质Am和Bn,已知2.4g Am和2.1 g Bn所含的原子个数相同,分子个数比为2:3,又知A和B的原子核内质子数都等于中子数,且A原子中的L电子层所含电子数是K电子层的3倍,试推断:
(1)A、B各是什么元素?
(1) Am中的m值是多少?
(2) Am的同素异形体的分子式。
21(8分)量取100ml、1mol/L盐酸与10 gFeS作用,将生成的H2S气体通入0.5L0.1 mol/L的NaOH溶液中,问:吸收全部气体后溶液中生成的是正盐还是酸式盐?其物质的量浓度是多少?
参考答案
一.选择题
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
答案 |
B |
C |
C |
C |
A |
B |
A |
C |
B |
A |
C |
A |
A |
A |
C |
二.实验题
16.(1).C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(2).④②①③
(3).红色褪去,不褪色,检验SO2,除去SO2,检验SO2是否除干净.
(4).无水CuSO4粉末,H2O.
(5).澄清石灰水,CO2,Ca2++2OH-+ CO2=CaCO3↓+ H2O.
17. CO. H2; CO2,H2O;N2.
三.填空题
18.(1)五、VIIA、紫黑、碘酒.
(2)C.(3)D.(4)A;A、C。(5)C
19.H、O、Na、S。极性共价键,共价; NaHSO3+ NaHSO4=Na2SO4+H2O+SO2↑
四.计算题
20.(1)O,N. (2)2. (3)O3
21.酸式盐,0.1mol/L