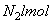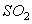推荐文章
- 高中毕业会考化学试卷
- 高中化学毕业考试
- 高中会考化学模拟卷(3)
- 高中二年级化学上学期期中考试卷
- 重要的氧化剂和还原剂
- 酸碱中和滴定专项训练
- 酸碱中和滴定
- 说明
- 苯、芳香烃
- 糖类蛋白质同步训练
- 第四节第一课时
- 第二节第二课时
2007学年12月高二月考化学试题
山东省泰安一中2006-2007学年十二月份月考
高 二 化 学 试 题 2006.12
总分100分
第I卷(选择题,共52分)
一、选择题(本题包括15个小题,每题2分,共30分。每题有一个选项符合题意。)
1、关于原子结构模型的演变过程,正确的是( )
A、汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
B、汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型
C、道尔顿原子模型→卢瑟福原子模型→汤姆逊原子模型→玻尔原子模型→量子力学模型
D、道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
2、氢原子的电子云图中小黑点表示的意义是( )
A、1个小黑点表示一个电子
B、小黑点的多少表示电子个数的多少
C、表示电子运动的轨迹
D、表示电子在核外空间出现机会的多少
3、使用微波炉加热,具有使受热物质均匀、表里一致、速度快、热效率高等优点。其工作原理是通电炉内的微波场以几亿的高频改变外电场的方向,水分子因而能迅速摆动,产生热效应,这是因为( )
A、水分子具有极性共价键 B、水分子中有共电子对
C、水由氢、氧两种元素组成 D、水分子是极性分子
4、为揭示原子光谱是线状光谱这一事实,玻尔提出了核外电子的分层排布理论,下列说法中,不符合这一理论的是( )
A、电子绕核运动具有特定的半径和能量
B、电子在特定半径的轨道上运动时不辐射能量
C、电子跃迁时,会吸收或放出特定的能量
D、提示了氢原子光谱存在多条谱线
5、能说明两个电子具有相同的能级的量子数为( )
A、n B、n、m C、n、l D、m、l
6、量子数n相同,l不同的各原子轨道的能量却相同的原子是( )
A、He B、H C、Li D、Be
7、假定有下列电子的各套量子数,指出可能存在的是( )
A、 ![]() B、
B、 ![]()
C、 ![]() D、
D、 ![]()
8、已知某原子的各级电离能数值如下: ![]()
![]() ,则该原子形成离子的化合价为( )
,则该原子形成离子的化合价为( )
A、 1 B、 2 C、 3 D、 4
9、若将6C原子的电子排布写成了 ![]() ,它违反了( )
,它违反了( )
A、能量守恒原理 B、能量最低原则
C、洪特规则 D、泡利不相容原理
10、有四个电子层的某一元素原子中未成对电子数最多可达( )
A、4个 B、5个 C、6个 D、7个
11、磁量子数(m)决定了原子轨道在空间的伸展方向,共有多少种( )
A、m种 B、n l种 C、2n种 D、2l 1种
12、O、S、As三种元素比较,正确的是( )
A、电负性O>S>A s,原子半径O<S<As
B、电负性O<S<As,原子半径O<S<As
C、电负性O<S<As,原子半径O>S>As
D、电负性O>S>As,原子半径O>S>As
13、下列各组分子中都属于含极性键的非极性分子的是( )
A、CO2、H2S B、C2H4、BF3
C、AlCl3、C2H2 D、NH3、HCl
14、下列关于苯分子的性质描述错误的是( )
A、苯分子呈平面正六边形,六个碳碳键完全相同,键角皆为120°
B、苯分子中的碳原子,采取SP2杂化,六个碳原子中未参与杂化的2p轨道以“肩并肩”形式形成一个大π键
C、苯分子中的碳碳双键是介于单键和双键之间的一种非凡类型的键
D、苯能使溴水和KMnO4溶液褪色
15、下列说法中不正确的是( )
A、σ键比π键重叠程度大,形成的共价键强
B、两个原子之间形成共价键时,最多有一个σ键
C、气体单质中,一定有σ键,可能有π键
D、N2分子中有一个σ键,2个π键
二、选择题(本题包括11个小题,每题2分,共22分。每题有一个或两个选项符合题意。)
16、下列说法中正确的是( )
A、非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B、非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C、最外层有2个电子的原子都是金属原子
D、最外层有5个电子的原子都是非金属原子
17、某金属形成阳离子后,其d轨道有5个未成对电子,该阳离子是( )
A、Cr(III) B、Fe(II) C、Fe(III) D、Mn(II)
18、下列各分子中所有原子都满足最外层8电子结构的是( )
A、BeCl2 B、PCl3 C、PCl5 D、N2
19、从实验测得不同物质中氧—氧之间的键长和键能数据:( )
O—O键
数据
![]()
![]()
![]()
![]()
键长/ ![]()
149
128
121
112
键能/ ![]()
x
y
z=494
w=628