|
班级_______姓名________得分________
1. 下列物质中不具有漂白性的是:
A. SO2 B. Na2O2 C. Na2O D. 新制氯水
2. 以下各种情况下不能产生硫化氢的是:
A. 鸡蛋腐败 B. 浓硫酸和硫化亚铁反应
C. 硫化钠和稀硫酸反应 D. 硫化铜投入稀盐酸中
3. 下列反应中,不能产生黑色固体的是:
A. 铜在硫蒸气中燃烧 B. 铁丝在氧气中燃烧
C. 氯气与硫化氢气体混和 D. 氯化锌溶液与硫化钠溶液混和
4. 能在空气中稳定保存的物质是:
A. 亚硫酸 B. 亚硫酸钠 C. 硒化氢水溶液 D. 硫黄
5. 除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是:
A. 饱和碳酸钠溶液 B. 高锰酸钾溶液
C. 石灰水 D. 饱和碳酸氢钠溶液
6. 硫酸盐种类很多,有的在实际应用上很有价值,如作净水剂、媒染剂、防腐剂、X射线造影剂、缓泻剂、颜料等。同时具有上述三种或三种以上用途的是:
A. 芒硝 B. 皓矾 C. 明矾 D. 硫酸铁
7. 不能说明氧的非金属性比硫强的是:
A. 在通常状况下,氧的单质为气体,硫的单质为固体
B. 氢硫酸溶液在空气中置露会变浑浊
C. 硫化氢在加热的条件下既可分解成氢气和硫,而水在强高温时很少分解
D. 铜与硫反应生成硫化亚铜,与氧气反应生成氧化铜
8. 在氯化钡溶液中通入SO2,溶液仍澄清,若将氯化钡溶液分装两只试管,一支加硝酸,另一支加NaOH溶液,然后再通入SO2,结果两试管中都有白色沉淀生成。由此得出下列结论合理的是:
A. 氯化钡有两性
B. 两支试管中的白色沉淀都是BaSO4
C. SO2具有还原性和酸性
D. 升高pH值使SO2水溶液中SO32-浓度增大
9. a克铜与足量的浓硫酸共热,完全反应产生标况下b升气体,则被还原的硫酸不可能是:
A. a/64mol B. ab/32mol C. 94a/64g D. 98b/22.4g
10. 密度为1.45克/厘米3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止。已知沉淀物与原溶液的质量相等,则原硫酸溶液的物质的量浓度为:
A. 29.6% B. 42.1% C. 14.8摩/升 D. 6.22摩/升
11. 某元素的硫酸盐的分子量为a,同价态的该元素的碳酸盐的分子量为b,则该元素的化合价数值为:
A. (a-b)/(a+b) B. (b-a)/36
C. (a-b)/36 D. (b-a)/18
12. 某Na2SO3样品已部分被氧化为Na2SO4,经测定该混和物中含硫25%,则混和物中Na2SO3与Na2SO4的物质的量之比为:
A. 7︰6 B. 6︰7 C. 1︰7 D. 7︰1
13. 含杂质SiO2的硫铁矿样品1克,用充足的O2燃烧后称重为0.8克,则硫铁矿中含硫量为:
A. 10% B. 22% C. 32% D. 40%
14. 充分煅烧黄铁矿W克,反应后得到固体N克,生成SO2 P克,假设杂质在煅烧过程中不参加反应,则黄铁矿的百分含量可表示为:
A. 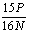 ×100% B. ×100% B.  ×100% ×100%
C. 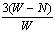 ×100% D. ×100% D. 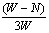 ×100% ×100%
15. 在常温常压下,将a升SO2和b升H2S混和,当反应后气体体积是反应前气体体积的1/4时,则a与b之比是: ①1︰1 ②1︰2 ③1︰3 ④2︰1
A. ① B. ②③ C. ③④ D. ①③
16. 向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量:
A. 小于0.45摩 B. 等于0.45摩
C. 在0.45摩与0.90摩之间 D. 大于0.90摩
17. 向三氯化铁和氯化钡的混和溶液中通入二氧化硫气体,有白色沉淀生成,此沉淀是:
A. 硫化亚铁 B. 硫磺 C. 亚硫酸钡 D. 硫酸钡
18. 相同浓度、相同体积的稀硫酸与足量的下列物质反应,所得溶液的物质的量的浓度最大的是:
A. ZnS B. ZnO C. Zn(OH)2 D. ZnCO3
19. 含FeS2A%的黄铁矿W吨,在用接触法硫酸的过程中,损失硫C%,可制得浓度为B%的硫酸为:
A. 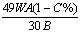 吨 B. 吨 B.  吨 C. 吨 C. 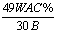 吨 D. 吨 D.  吨 吨
20. 石膏[CaSO4·2H2O]加热到150—170℃时,会失去部分结晶水而生成熟石膏[2CaSO4·H2O],则通过加热每生成1摩熟石膏失去水的物质的量为:
A. 1摩 B. 1.5摩 C. 2摩 D. 3摩
21. 在氧气中燃烧0.4克硫和铁组成的化合物样品,使其中硫全部转化为SO2,又全部转化为硫酸,这些硫酸可以跟20毫升0.5摩/升的NaOH溶液完全中和,原化合物中硫的百分含量是:
A. 40% B. 46% C. 53% D. 73%
22. 已知在FeSO4和Fe2(SO4)3组成的混和物中,硫元素的质量百分含量为a%,则混和物中铁元素的质量百分含量为:
A. (100-a)% B. (100-2a)% C. (100-3a)% D. (100-4a)%
23. 24毫升H2S在30毫升O2中燃烧,在同温同压下,得到的SO2的体积是:
A. 24毫升 B. 30毫升 C. 20毫升 D. 18毫升
24. 将绿矾晶体加热,除失去结晶水外,还发生下列反应:2FeSO4=Fe2O3+SO2↑+SO3↑。若将该反应的气体通入氯化钡溶液,则有:
A. 硫酸钡沉淀 B. 亚硫酸钡沉淀 C. SO3气体逸出 D. SO2气体逸出
25. 下列哪些事实是由于氯的非氧化性比硫强的结果:
A. 次氯酸的酸性比硫酸弱 B. 氯能置换硫化氢中的硫
C. 硫离子的还原性比氯离子强 D. 硫能在空气中燃烧,而氯则不能
26. 下列反应产生的气体,通过Na2SO3溶液而不反应的是:
①Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸 ④浓硝酸和铜片
⑤铜片和浓硫酸共热 ⑥固体NaCl和浓H2SO4 ⑦FeS和稀硝酸
A. ①② B. ② C. ①②⑤ D. 全部反应
27. 现有1升含SO3为30%的发烟硫酸(密度为1.95克/毫升),要把它稀释为浓度为95%的硫酸,需加入水的体积约为:
A. 120毫升 B. 180毫升 C. 241毫升 D. 300毫升
28. 用浓硫酸吸收SO3可得到H2SO4·SO3,若用1.00克98%的硫酸溶液充分吸收SO3后,再进行稀释,可得到98%的硫酸质量为:
A. 1.98克 B. 2.00克 C. 2.22克 D. 2.42克
29. 下列不能用浓硫酸来干燥的气体是:
A. HCl B. HI C. SO2 D. NH3
30. 跟100毫升 0.1摩/升(NH4)2SO4溶液中的NH4+浓度相同的是:
A. 0.1摩/升NH4NO3溶液100毫升 B. 0.2摩/升NH4NO3溶液100毫升
C. 0.2摩/升 NH4Cl溶液200毫升 D. 0.2摩/升(NH4)2SO4溶液50毫升
31. 下列反应可用化学方程式SO2+Br2+2H2O=H2SO4+2HBr表示的有:
①把SO2气体通入溴水中;②把液溴加入到SO2的水溶液中;③把硫酸与Na2SO3反应得到的气体通入溴水中;④把浓硫酸与溴化氢混和加热得到的红色气体通入水中
A. ①③④ B. ①③④ C. ①②③ D. ①②③④
32. 常温下,向20升真空容器中通入a摩尔硫化氢,与b摩尔氯气(a,b均为正整数,且均≤5),反应后可生成硫固体和另一种气体,则容器内可能达到的最大密度是:
A. 35.5克/升 B. 17.85克/升 C. 18.25克/升 D. 19.45克/升
33. 常温下,向20升真空容器中通入a摩尔硫化氢和b摩尔氯气(a和b都是正整数,且均小于或等于5),反应完全后,容器内气体可能达到的最在密度是:
A. 19.45克/升 B. 18.25克/升 C. 17.85克/升 D. 35.5克/升
34. 用足量的氢气和氧气分别跟m克硫反应,并将生成物混和,可生成的硫为:
A. 2m克 B. 1.5m克 C. m克 D. 0.5m克
35. 为除去SO2中混有的少量SO3,并使所得物质的平均分子量尽可能地增大,应选用的物质是:
A. 亚硫酸钠溶液 B. 亚硫酸氢钠溶液
C. 碱石灰 D. 浓硫酸
36. 298K时,向V升真空容器中通入n摩SO2和m摩H2S。若5n=m,且反应后氧化产物与还原产物的质量和为48克,则n与m之和为:
A. 1 B. 2 C. 3 D. 4
37. 把11.9克H2S和11.2升(标准状况)O2,在一密闭容器中混和,在一定条件下充分反应后,测知反应物无剩余,再回复到原来状况,则容器中氧化产物的总质量是:
A. 10.8克 B. 11.2克 C. 21.6克 D. 22.4克
38. 将x摩 Na2SO3和y摩Na2S溶于水中,用硫酸酸化后,①若生成S和SO2,②若生成S和H2S,③若只生成S,则x︰y的值依次为:
A. >1/2,=1/2,<1/2 B. >1/2,<1/2,=1/2
C. =1/2,>1/2,<1/2 D. <1/2,>1/2,=1/2
[1] C
[1] B、D
[1] C、D
[1] D
[1] B、D
[1] B
[1] A
[1] C、D
[1] B、C
[1] D
[1] C
[1] D
[1] C
[1] B、C
[1] D
[1] A
[1] D
[1] A
[1] A
[1] D
[1] B
[1] A
[1] C
[1] D
[1] A、D
[1] B、C
[1] B
[1] D
[1] C
[1] C
[1] B、D
[1] B、C
[1] D
[1] C
[1] B
[1] B
[1] D
[1] C
[1] C
[1] B
|