推荐文章
- 高中毕业会考化学试卷
- 高中化学毕业考试
- 高中会考化学模拟卷(3)
- 高中二年级化学上学期期中考试卷
- 重要的氧化剂和还原剂
- 酸碱中和滴定专项训练
- 酸碱中和滴定
- 说明
- 苯、芳香烃
- 糖类蛋白质同步训练
- 第四节第一课时
- 第二节第二课时
《电离平衡》 检测题
高二化学“必修本”专用
第二章 《电离平衡》 检测题
(测验时间40分钟)
班次 学号 姓名 成绩
题号
1
2
3
4
5
6
7
8
9
10
11
12
*13
*14
选项
| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
一、选择题(每题有1~2个选项符合题意,每小题4分,共48分+10分。) 1.下列说法正确的是 A.强电解质一定是离子化合物 B.强电解质、弱电解质的电离都是吸热过程 C.强电解质的饱和溶液一定是浓溶液 D.强电解质在水中一定能全部溶解 2.物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是 A.NH4Cl B.NaCl C.CH3COONa D.NaNO3 3.在CH3COOH溶液中存在如下平衡:CH3COOH A.NaCl B.CH3COONa C.Na2CO3 D.NaOH 4.下列物质在水溶液中存在着电离平衡的是 A.HF B.NHO3 C.C2H5OH(酒精) D.Na2SO4 5.某固定化合物A不导电,但熔化或溶于水都能完全电离。下列关于物质A的说法中,正确的是 A.A为非电解质 B.A是弱电解质 C.A是离子化合物 D.A为易溶性盐 6.将①H 、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是 A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧ 7.下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是 A.⑥③①②⑤④ B.⑤①②⑥④③ C.⑤④③②①⑥ D.③①②④⑤⑥ 8.100 mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的 A.碳酸钠(s) B.醋酸钠(s) C.硫酸钠(aq) D.硫酸钾(s) 9.若溶液中由水电离产生的[OH-]=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是 A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3- C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3- 10.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是 A.反应开始时的速率:甲=乙 B.反应所需时间:甲<乙 C.反应开始时,酸的物质的量浓度:甲<乙 D.反应结速时,pH值:甲<乙 11.在某温度下,将某NaOH溶液和0.1 mol ·L-1的HAc溶液充分混合后,若溶液呈中性,则该混合溶液中有关离子的浓度应满足的关系是 A.[Na+]=[Ac-] B.[Na+]>[Ac-] C.[Na+]<[Ac-] D.[Na+]+[H+]=[OH-]+[Ac-] 12.常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是 A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B.c(Na+)+c(H+)>c(CH3COO-)+c(OH-) C.c(CH3COO-)>c(Na+)>c(H+)=c(OH-) D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) *13.将0.1 mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起 A.溶液的pH增加 B.CH3COOH电离度变大 C.溶液的导电能力减弱 D.溶液中[OH-]减小 *14.在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3 ④Na2S,所含带电微粒的数目由多到少的顺序是 A.①=④>③=② B.①=④>③>② C.①>④>③>② D.④>①>③>② 二、填空题 15.(16分)根据NH2·H2O的电离方程式 。结合变化量填下表。
|
| H2O
| NH4Cl (s)
| NaOH (s)
| HCl (1)
| (1)Kb
|
|
|
|
| (2)n (OH-)
|
|
|
|
| (3)c (OH-)
|
|
|
|
| (4)平衡移动方向
|
|
|
| |
16.(10分)当滴有少量CH3COOH的CH3COONH4的混合物溶于水后,存在着的电离或离子反应的平衡有:
(1) ,(2) 。
(3) 。
由于 平衡的存在,抑制了 平衡的移动。
17.(6分)某可溶性盐的化学式XmYn(m≠n),将一定量的该盐溶于适量的水中。
(1)若测得溶液的pH为3,则该盐与水反应的离子方程式可能为
。
(2)若该盐水溶液的pH为11,则其与水反应的离子方程式可能为
。
 三、实验题(10分)
三、实验题(10分)
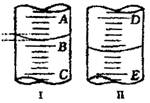
18.如图
(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,假如刻度A为4,量筒中液体体积是 mL。
(2)图II表示50mL滴定管中液面的位置,假如液面处的读数是a,则滴定管中液体的体积(填代号) 。
A.是a mL B.是(50-a)mL
C.一定大于a mL D.一定大于(50-a)mL
四、计算题(10分+10分)
19.量取25.00mL未知浓度的硝酸溶液,用去10.50mL浓度为0.120mol·L-1NaOH溶液进行滴定,又再用去14.50mL浓度为0.120mol·L-1的KOH继续滴定恰好安全反应,求该HNO3溶液的浓度是多少?
*20.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A ![]() H++HA-,
H++HA-,
HA- ![]() H++A2-,已知K1>K2,设有下列四种溶液:
H++A2-,已知K1>K2,设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl溶液与0.04 mol·L-1的NaHA溶液等体积混合
D.0.02 mol·L-1的NaOH溶液与0.02 mol·L-1的NaHA溶液等体积混合
据此填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 。
(2)c(H2A)最大的是 ,最小的是 。
(3)c(A2-)最大的是 ,最小的是 。
第二章 电离平衡 检测题
参考答案
一、选择题(共48分+10分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
*13
*14
选项
B
A
BD
A
C
B
A
BC
B
AC
AD
A
A
D
二、填空题(共32分)
15.(16分)NH3·H2O ![]() NH4++OH-;
NH4++OH-;
(1)不变,不变,不变,不变;
(2)增加,减少,增加,减少;
(3)减少,减少,增加,减少;
(4)正向,逆向,逆向,正向。
16.(10分)(1)CH3COOH ![]() CH3COO-+H+,
CH3COO-+H+,
(2)NH4++H2O ![]() NH3·H2O+H+
NH3·H2O+H+
(3)CH3COO-+H2O ![]() CH3COOH+OH- (1), (3)
CH3COOH+OH- (1), (3)
17.(3分)(1)Xn +nH2O ![]() X(OH)n+nH
X(OH)n+nH
(3分)(2)Ym-+H2O ![]() HY(m-1)-+OH-
HY(m-1)-+OH-
三、实验题(10分)
18.(1)3.2 (2)D
四、计算题(共10+10分)
19.(10分)
解:C(HCl)= ![]() =0.120mol·L-1
=0.120mol·L-1
*20.(10分)
(1)A,D (2)C,D (3)D,A
| |