相对原子质量:O 16 H 1 C12 N 14 Ne 20
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.以美国为首的北约部队在对南联盟的狂轰滥炸中使用了大量的贫铀弹。所谓“贫铀”
是从金属铀中提取出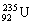 以后的副产品,其主要成分是具有低水平放射性的
以后的副产品,其主要成分是具有低水平放射性的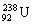 。下列有关
。下列有关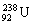 的说法中正确的是
的说法中正确的是
A.中子数为146 B.质子数为238 C.质量数为330 D.核外电子数为146
2.在任何原子里都具有的粒子是
A.质子、中子、电子 B.质子、中子
C.质子、电子 D.中子、电子
3.X、Y为两种不同的元素,它们组成了下列物质,这些物质的分子肯定有极性的是
A.XY4 B.XY3 C.XY2 D.XY
4.下列事实中能证明氯化氢是共价化合物的是
A.氯化氢极易溶于水 B.液态氯化氢不导电
C.氯化氢不易分解 D.氯化氢溶液可以导电
5.A和B都是主族元素,A的原子序数为n,A2+比B2—少8个电子,则B的原子序数是
A.n+2 B.n+4 C.n+6 D.n+10
6.在元素周期表中,单质在常温下有气态、液态、固态的是
A.ⅠA族 B.ⅤA族 C.ⅥA族 D.ⅦA族
7.含6.02×1023个中子的 Li的质量是
Li的质量是
A.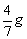 B.4.7 g C.7.4g D.
B.4.7 g C.7.4g D.
8.下列元素的最高价氧化物对应水化物的酸性最弱的是
A.Si B.P C.S D.Cl
9.一种粒子的质子数和电子数分别与另一种粒子的质子数和电子数相同,则下列说法中错误的是
A.可能是不同的分子 B.可能是不同的离子
C.可能是一种离子和一种分子 D.可能是不同的原子
10.某元素的原子最外层只有一个电子,它跟卤素相结合时,可形成的化学键
A.一定是共价键 B.一定是离子键
C.可能是共价键,也可能是离子键 D.上述说法都不正确
11.下列原子最难形成离子的是

12.若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是
A.1 B.3 C.5 D.6
13.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是
A.X的原子序数比Y小 B.X的原子的最外层电子数比Y的大
C.X的原子半径比Y的大 D.X元素的最高正价比Y的高
14.某元素X原子的最外层电子数是电子层数的三倍,则X元素在周期表中
A.一定位于第2周期 B.一定位于IIIA族
C.一定位于第3周期 D.一定位于VA族
15.对Na Mg Al的有关性质的叙述正确的是
A.碱性:NaOH>Mg(OH)2>Al(OH)3
B.原子半经:Na<Mg<Al
C.离子的氧化性:Na+>Mg2+>Al3+
D.单质的还原性:Na<Mg<Al
二、选择题(本题包括10小题每小题2分,共20分。每小题有一个或二个选项符合题意)
16.两种不同的粒子,具有相同的质子数,它们不可能是
A.同一原子 B.同一种元素 C.不同种分子 D.不同的原子
17.下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HlO4
B.碱性:Al(OH)3>Ca(OH)2>Mg(OH)2
C.稳定性:HCl>H2S>PH3
D.还原性:HF>HCl>HBr
18.设N0表示阿伏加德罗常数的值,下列说法正确的是
A.N0个氧气分子与N0个氖气分子的质量比是4:5
B.17gOH-与19gH3O+所含电子数相等
C.14g14C和12g12C所含的中子数相等
D.标准状况下11.2LCO2与常温常压下8.5gNH3所含分子数相等
19.下列哪一组元素的原子间反应可以形成离子键:
|
原子 |
a |
b |
c |
d |
e |
f |
g |
|
M层电子数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
A.a和c B. a和f C. d和g D. b和g
20.下列说法中正确的是
A.非极性分子中的化学键必定全部是非极性键
B.极性分子中的化学键必定全部是极性键
C.离子化合物中的化学键必定都是离子键
D.共价化合物中的化学键必定都是共价键
21.在下列各对化合物中,化学键类型相同的是
A.HCl和MgCl2 B.H2O和CO2 C.CO2和CH4 D.F2和NaF
22.A元素的最高正价和负价的绝对值之差为6, B元素和A元素的原子次外层都有8个电子,BA2在水溶液中电离出电子层结构相同的离子,则BA2是
A.MgF2 B.CaCl2 C.K2S D.Na2O
23.下列电子式或结构式错误的是
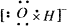
A.OH-的电子式

B.NH4Br的电子式
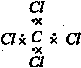
C.CCl4的电子式
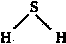
D.H2S的结构式
24.右图是周期表中短周期的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是
A.a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a
B.d的氢化物比b的氢化物稳定
C.a与c不能形成化合物
D.原子半经的大小顺序是c>b>a>d
25.通常把具有相同电子数和相同原子数的分子或离子称为等电子体。等电子体的结构和性质相似(等电子原理)。有下列两个系列的物质:
|
系列一 |
CH4 |
C2H6 |
CO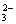 |
Y |
C2O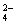 |
W |
|
系列二 |
NH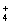 |
N2H |
X |
NO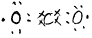 |
Z |
N2 |
试根据等电子体的概念及上述两系列物质的排列规律,推断X、Y、Z、W可能是下列各组物质中的
A.NO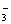 CO2 N2O4 CO B.NO
CO2 N2O4 CO B.NO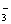 CO2 N2H4 C2H2
CO2 N2H4 C2H2
C. NO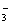 CO NO
CO NO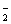 C2H2 D. NO
C2H2 D. NO HCO
HCO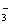 N2O
N2O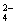 CO
CO
三、填空题(本题24分)
26.在第3周期元素及其单质和化合物中,原子半径最小的元素是________;氧化性最强的单质是_________,还原性最强的单质是_________;溶沸点最低的单质是________;最高价氧化物对应水化物中,最强的酸是______,最强的碱是_________;形成的两性化合物有_______
_____。
27.在下列变化中①I2升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水。未破坏化学键的是________;仅离子键被破坏的是_______;仅共价键被破坏的是_________;离子键和共价键同时被破坏的是__________ 。
28.短周期元素X、Y、Z在周期表中的位置关系如右图
(1) X单质的分子式为_________ ,若X核内的质子数等于中子数,则X的摩尔质量为
__________。
(2)Y的单质与水反应的化学方程式为___________________________________,Y与氢形成的化合物HY的电子式为____________,H—Y键为_________键(填“极性”或“非极性”)
(2) Z与同族的元素形成化合物的分子式是_____________________________________
_________________。
29.有H、D、T三种原子、它们之间的关系是______。在标准状况下,它们的单质的密度之比是___________;1mol各种单质中,它们的质子数之比是________;在标准状况下,1L各种单质中它们的电子数之比是_______.
30.在水溶液中,YO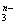 和S2-发生的离子与方程式如下:
和S2-发生的离子与方程式如下:
YO +3S2-+6H+=Y-+3S+3H2O
+3S2-+6H+=Y-+3S+3H2O
(1)YO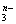 中Y元素的化合价为____________
中Y元素的化合价为____________
(2)若Y-具有稳定结构,则Y元素的最高正化合价为_________。
(3)YO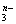 在其他化学变化中能否充当还原剂________(答“能”或“不能”)
在其他化学变化中能否充当还原剂________(答“能”或“不能”)
四、推断题(本题共7分)
31.有A、B、C三种元素,A是周期表中原子半径最小的元素;B、C元素的原子核外次外层的电子数均为2,B原子L层上的电子数为K层的2倍,且B与C能形成BC和BC2两种气态化合物;A和B、C分别形成的两种化合物分子中含有A原子的个数比为2:1,但两种物质每分子中电子的总数均为10个;A和C形成的化合物常温下为液态。
(1) 试推断A、B、C三种元素。其元素符号分别为_______、_______、_______。
(2) BC2的电子式为___________。
(3) A和B形成化合物分子的结构式为_________,该分子是________性分子。
(4) 用电子式表示A、C形成化合物的过程_________.
五、(本题4分)
32.实验室为验证同主族元素性质递变规律,准备了如下药品:
①AgNO3溶液 ②稀HCO3 ③Br2水 ④I2水 ⑤NaOH溶液
⑥NaCl溶液 ⑦NaBr溶液 ⑧H2O ⑨Na ⑩Mg eq oac(○,11)11Al eq oac(○,12)12K
(1) 你准备选用的药品是(用编号表示)____________
(2) 你所做的实验是什么?(用方程式表示)判断依据是什么?
__________________________________________________________________________
______________________________________________________________________________
六、计算题:(本题共15分)
33.核电荷数为17的元素X可构成相对分子质量为70、72、74三种气态单质X2,此三种单质的物质的量之比为9:6:1。
则(1)X有_________种同位素,原子符号分别为__________
(2)三种单质的平均相对分子质量为______________
(3)各同位素所占原子百分比分别为______________。
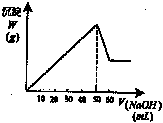
34.向硫酸铝和硫酸镁混合液中,逐滴加入2mol·L-1NaOH(aq),所生成沉淀(W)与加入NaOH(aq)的体积V的关系如图所示,则原混合液中C(Al3+)与C(Mg2+)之比为__________ C[Al2(SO4)3]与C(MgSO4)之比为_________.
 (本题将计算过程写在答题纸上)
(本题将计算过程写在答题纸上)
检测试题答案
一、1.A 2.C 3.D 4.B 5.B 6.D 7.D 8.A 9.C 10.C 11.B 12.D 13.C 14.A 15.A
二、16.A 17.BD 18.BD 19.BD 20.D 21.BC 22.B 23.C 24.CD 25.A
三、26. Cl ; Cl2 ; Na; Ar; HClO4; NaOH; Al(OH)3·Al2O3
27.①⑤ ;②③ ;④ ; ⑥ ;
28.(1) He ; 4g/mol
(2)Cl2+H2O=HCl+HClO; H 极性。
(3)SO2.SO3
29.同位素; 1:2:3; 1:1:1; 1:1:1。
30.(1)+5 (2)+7 (3)能
四、31(1)H、 C、 O。
(2)
(3) 非极
(4)

五、32.(1)⑧⑨ eq oac(○,12)12
(2)2Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
依据K与H2O反应比Na与H2O反应剧裂, 判断K比Na活泼
六、33(1)2; 
(2)71
(3)75% 25%
34.1:1;1:2