|
《电离平衡》综合检测题
一、选择题(每小题3分,共51分)
1.下列各种试纸,在使用时预先不能用蒸馏水润湿的是( )
A.红色石蕊试纸 B.蓝色石蕊试纸
C.碘化钾淀粉试纸 D.PH试纸
2.甲、乙两种溶液,已知甲溶液的PH值是乙溶液的2倍,甲溶液中[H ]一定是乙溶液中 [H ]的( )
A.1/2倍 B.1/10倍 C.1/100 D.无法确定
3.在0.01mol·L-1的硫酸溶液中,水电离出的H 浓度是( )
A.5×10-3mol·L-1 B.0.02mol·L-1
C.1×10-7mol·L-1 D.1×10-12mol·L-1
4.关于溶液的酸碱性说法正确的是( )
A.[H ]很小的溶液一定呈碱性
B.PH=7的溶液一定呈中性
C.[OH-]=[H ]的溶液一定呈中性
D.不能使酚酞试液变红的溶液一定呈酸性
5.下列说法正确的是( )
A.室温下,PH=8的碱性溶液中,可能存在CH3COOH分子
B.室温下,PH=6的酸性溶液中,不可能存在NH3·H2O分子
C.在0.1mol·L-1氢溴酸中加入适量的蒸馏水,溶液中[H ]减小,[OH-]增大
D.中性溶液中必然是[H ]=[OH-]=10-7mol·L-1
6.常温下PH=2的A酸溶液和PH=12的B碱溶液等体积混合后,溶液的PH一定小于7,则A、B可能 为( )
A.强酸、强碱 B.弱酸、弱碱 C.强酸、弱碱 D.弱酸、弱碱
7.美国等国发射的航天器将我国研制的磁谱仪带入太空,其目的是探索反物质,反物质主要 特征是电子带正电荷,质子带负电荷,以下表示反物质酸碱中和反应的通式是( )
A.H- OH =H2O B.H OH =H2O
C.H- OH-=H2O D.H OH-=H2O
8.0.01mol·LH2SO4滴定0.01mol·L-1NaOH溶液,中和后加水至100ml.若滴定时终点判定有 误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05ml),则①和②[H ]之比是( )
A.10 B.50 C.5×103 D.104
9.将AlCl3溶液和NaAlO2溶液分别蒸发并灼烧,所得产物的主要成份是( )
A.均为Al(OH)3 B.前者得Al2O3,后者得NaAlO2
C.均为Al2O3 D.前者得AlCl3,后者得NaAlO2
10.常温下某溶液中由水电离的[H ]=10-10mol·L-1,该溶液中溶质不可能是( )
A.NaHSO4 B.Al2(SO4)3 C.NaOH D.HCl
11.在蒸发皿中加热蒸干并灼烧下列物质的溶液可以得到该物质的固体是( )
A.Na2SO4 B.NH4HCO3 C.FeCl3 D.Ca(HCO3)2
12.若向无色透明的溶液中加入铝粉,反应后生成氢气,则原溶液肯定不存在的离子组是 ( )
A.Cl-、NO-3、Mg2 、K B.NH 4、Cl-、Na 、Ba2
C.SO2-4、Cl-、CO2-3、Na D.SO2 、K 、S2O2-3、NO-3
13.相同温度,相同物质的量浓度的四种溶液:①CH3COONa,②NaHSO4,③NaCl,④C6H5ONa,按PH值由大到小的顺序排列,正确的是( )
A.④①③② B.①④③② C.①②③④ D.④③①②
14.物质的量浓度相同的下列溶液中,NH 4浓度最大的是( )
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH4HCO3
15.对于0.1mol·L-1 NaHCO3溶液,下列叙述正确的是( )
A.[Na ]>[HCO3]>[CO2-3]>[H ]>[OH-]
B.[Na ]+[H ]=[HCO-3]+[OH-]+[CO2-3]
C.[Na ]+[H ]=[HCO-3]+[OH-]+2[CO2-3]
D.0.1=[HCO3]+[CO2-3]+[H2CO3]+[CO2]
16.把氨气通入稀盐酸中,当PH=7时,下列叙述正确的是( )
A.氨气过量 B.盐酸有剩余
C.溶液中[Cl-]=[NH 4] D.nNH3=nHCl
17.pH值相同的醋酸和盐酸,分别用蒸馏水稀释到原来体积的m倍和n倍,稀释后两溶液的pH 值仍相同,则m和n的关系是( )
A.m>n B.m=n C.m<n D.不能确定
二、简答题(每小题5分,共10分)
18.已知醋酸铵溶液约为中性,又知醋酸加入碳酸钠溶液中有气体放出,试推断碳酸氢铵溶液的PH是大于、小于还是等于7?
19.近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式 为:NH3 HClO  H2O NH2Cl(一氯氨),NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因. H2O NH2Cl(一氯氨),NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因.
三、填空题(共39分)
20.(6分)某盐的化学式XmYn为最简结构(m≠n),将一定量的该盐溶于足量水时:
(1)若测得溶液的PH为5,则该盐与水反应的离子方程式可能为 .
(2)若测得该盐溶液的PH为9,则该盐与水反应的离子方程式可能为 .
(3)若x、y为同周期的短周期元素,XmYm溶于水时,既有白色沉淀产生,又有无色气体 放出,则XmYm溶于水的化学方程式为 .
21.(6分)含有一定量CH3COONa和CH3COOH的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的PH值几乎不变,这可由下列离子方程式来说明:
加酸时:CH3COO- H =CH3COOH
加碱时:CH3COOH OH-=CH3COO- H2O 由于CH3COOH和CH3COO-的大量存在,加少量酸或碱时,溶液中[H ]与[OH-] 基本保持不变.
(1)含有一定量NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入酸或碱时发生的离子反应方程式:
加酸时 ;
加碱时 .
(2)请举出可形成缓冲溶液的一组物质: 和 .
22.(7分)用已知浓度的盐酸滴定未知浓度的氢氧化钾溶液,滴定过程中进行如下操作,分别 指出各项的操作对测定结果的影响(可用“偏高”、“偏低”、“无影响”).
(1)滴定前,滴定管尖咀处有气泡,滴定后气泡消失. .
(2)滴定管经蒸馏水洗涤后,即装入标准溶液进行滴定. .
(3)滴定前,锥形瓶用蒸馏水洗涤后,未用待测的氢氧化钾溶液润洗就做滴定. .
(4)用移液管量取待测液后,又用蒸馏水洗涤移液管,并将洗涤液一起注入锥形瓶中. .
(5)滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外. .
(6)滴定管读数时,用俯视记终点. .
(7)滴定完毕后,在滴定管尖咀外留有液滴. .
喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800名四周居民在一夜之间神秘死去 ,后经科学家考察发现,湖底有火山口,聚集了大量二氧化碳和二氧化硫等气体,并发现在 200m深的湖底每m3湖水竟溶解了8m3的有毒气体.目前科技人员已找到一种有效的办法将 湖底有毒气体抽出并加以处理.
回答23~24题的问题.
23.(5分)为了测定从湖底取出的水样中SO2的含量,可在一定的水样中加入一定量的碘(过 量),再用已知浓度的硫代硫酸钠溶液滴定过量的碘,该反应为:2Na2S2O3 I2=2Na I Na2S4O6
(1)碘和水样中SO2反应的化学方程式为: .
(2)用硫代硫酸钠滴定过量的碘时,应选用 作指示剂,当溶液 (填现象)便达到滴定终点.
(1) (1) 若在20ml水样中加入碘Wg,用去Vml cmol·L-1的Na2S2O3溶液,则水样中SO2的浓度
为 mol·L-1.
24.(5分)为了测定从湖底抽出的有毒气体中CO2的含量,需将CO2变成沉淀,然后测其质量,通过计算求出CO2的含量,从图中选择必要的装置(导管和胶管省略)设计实验,将CO2转变成沉淀.
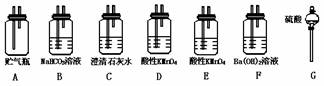
(1)其所选装置的连接顺序是(按从上到下从左至右的顺序) .
(2)将气体两次通过酸性高锰酸钾溶液的目的是 .
(3)是否需要选择装置B?为什么 .
(4)为了测得沉淀物的质量,还需进行的操作有 ;还需要的仪器有 .
25.(10分)维生素C是一种水溶性维生素(是水溶液呈酸性),它的分子式是C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化. 在新鲜的水果,蔬菜,乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量在500mg·L-1左右.
校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请 填写有关空白.
(1)测定目的:测定××品牌软包橙汁维生素C含量
(2)测定原理:C6H8O6 I2C6H6O6 2H 2I-
(3)实验用品及试剂
①仪器和用品:自选
②指示剂 (填名称),浓度为7.50×10-3mol·L-1标准溶液,蒸馏水.
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准溶液待用.
②打开橙汁包装,用 (填仪器名称),向锥形瓶中移入20.00ml待测橙汁,滴入2滴指 示剂.
③用左手控制滴定管的 (填部位),右手摇动锥形瓶,眼睛注视 直到滴定终点,滴定至终点的现象是
(5)数据记录与处理.(设计数据记录表格和数据处理的表格,不必填数据)若经数据处理,滴 定中消耗标准碘溶液的体积是15.00ml,则此橙汁中维生素C的含量是 mg·L-1 .
(6)问题讨论:
①滴定过程中能否剧烈摇动锥形瓶?为什么?
②从分析数据看,此软包装橙汁是否是纯天然橙汁? (填编号)
A.是 B.可能是 C.不是
制造商可能采取的做法是
A.加水稀释天然橙汁
B.橙汁已被浓缩
C.将维生素C作为添加剂
对上述做法,你的意见是
A. A. 同意 B.不同意 C.调查后再作结论
参考答案
第三章 《电离平衡》综合检测
一、1.D 2.D 3.A 4.C 5.AC 6.AC 7.A 8.D 9.B 10.B 11.A 12.A 13.A 14.B 15.CD 16.AC 17.A
二、18.因CH3COONH4溶液约为中性,故CH3COO-水解程度与NH-4水解程度相近,又向Na2CO3溶液中加CH3COOH有气体放出,可知CH3COOH酸性比碳酸强,故HCO-3水解程度比CH3COO-水解程度大,HCO-3水解程度比NH 4水解程度大,故NH4HCO3溶液呈碱性,即PH>7.
19.加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述平衡又向左移动,又产生HClO起杀菌作用.
三、20.(1)Xn nH2O 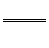 X(OH)n nH X(OH)n nH
(2)Ym- H2O 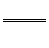 HY(m-1) OH- HY(m-1) OH-
(3)Al2S3 6H2O 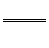 2Al(OH)3 3H2S 2Al(OH)3 3H2S
21.(1)HPO2-4 H =H2PO-4H2PO-4 OH-=HPO2-4 H2O
(2)NH4Cl和NH3·H2O或Na2CO3和NaHCO3等
22.(1)偏高 (2)偏高 (3)无影响 (4)偏高 (5)偏低 (6)偏低 (7)偏高
23.(1)I2 SO2 2H2O=2HI H2SO4
(2)淀粉 由蓝色变无色时 (3)( 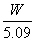 - - 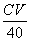 ) )
24.(1)GADEF (2)为了充分除去有毒气体SO2 (3)不需要 因SO2会和NaHCO3水溶液反应生成CO2而影响测定原气体中CO2的含量 (4)过滤 洗涤 干燥 称量 铁架台 过滤器 玻璃棒 烧杯 干燥器 天平
25.(3)②淀粉溶液 (4)②酸式滴定管 ③活塞;锥形瓶中溶液颜色的变化及滴定管中液体流下的速度;溶液变蓝色且在半分钟内不褪去
(5) |
滴定次数 |
待测液体积(ml) |
标准碘液体积(ml) | |
滴定前刻度 |
滴定后刻度 |
实际体积 |
平均值 | |
1 |
|
|
|
|
| |
2 |
|
|
|
|
| |