| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
17、NA表示阿伏加德罗常数,以下说法中不正确的是 ( ) A.常温常压下,n mol DT含有核外电子数为2nNA B.1 L 0.01mol/L的H2SO3中,含H 个数小于0.02 NA C.标准状况下,22.4L SO2和SO3所含硫原子数为NA D.标准状况下,11.2L以任意比例混合的NO和O2混合气体中含气体的分子数为NA/2 18、下列各组离子,在指定的环境中一定能大量共存的有 ( ) A.pH=7的溶液中:Al3+、K 、SO42-、HCO3- B.能使pH试纸变为深蓝色的溶液中:S2—、SO32-、S2O32-、CO32- C.能使甲基橙指示剂变为红色的溶液中:Mg2 、Ca2 、OH—、SO42- D.水电离出c(OH—)=1×10—13mol/L的溶液中:Fe2+、NH4 、ClO-、Cl- 19、下列反应的离子方程式书写正确的是 ( )
B、电解饱和食盐水:2Cl—+2H2O==H2↑+C12↑+2OH— C、碳酸钙与盐酸反应:CaCO3+2H+==Ca2++CO2↑+H2O D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液: Fe2++2H++H2O2==Fe3++2H2O 20、将0.2moL/L的CH3COONa溶液与0.1mol/L的硝酸溶液等体积混合后,溶液中下列粒子的物质的量浓度的关系正确的是 ( ) A.C(CH3COO-) C (NO3-) C (OH-)= C (H ) C (Na ) B.C(CH3COO-)= C (Na )= C (NO3-)> C(CH3COOH)> C (H )> C (Na ) C.C(CH3COO-)> C (NO3-)> C(CH3COOH) = C (Na ) >C (H ) > (OH-) D.C(Na )>C(CH3COO-)> C (NO3-)>C(CH3COOH) > C (H )> C (OH-) 21、固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下答应氧离子(O2- )在其间通过。该电池的工作原理如下左图所示,其中多孔电极a、b均不参与电极反应。下列判定正确的是 ( ) A.有O2参加反应的a极为电池的负极 B.有H2参加反应的b极为电池的正极 C.a极对应的电极反应式为O2 2H20-4e=40H-
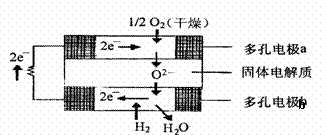 D.该电池的总反应方程式为:2H2 02=2H2O D.该电池的总反应方程式为:2H2 02=2H2O
22、在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
下列判定一定错误的是 ( ) A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 23、在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是 ( ) A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 B.甲烧杯中的酸过量 C.两烧杯中参加反应的锌等量 D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 24、1.6gCu与50mL 的8mol·L-1 HNO3充分反应,硝酸的还原产物有NO和NO2,反应后混合溶液中H 浓度为a mol·L-1(生成水的体积忽略不计),则此时溶液中所含NO3—的物质的量为 ( ) A.(a 1)mol B.(0.4 0.5a)mol C.(a 0.05)mol D.0.05(a 1)mol 25、铝与Na2O2的混合物溶于足量水中,得到澄清溶液,同时产生气体3.5g,在所得溶液与7mol/LHCl 100mL作用过程中,先有白色沉淀生成,此后沉淀又恰好溶解,则Al与Na2O2的物质的量之比为 ( ) A.2∶1 B.1∶2 C.11∶2 D.2∶11
第Ⅱ卷(非选择题,共50分) 三、本题包括2小题,共18分
依据上述步骤,完成下列填空: (1)溶液中的硝酸应该用 硝酸(填浓或稀),原因是 a减少过程中产生NOx的量 b减小原料Ag的消耗量 c节省硝酸物质的量 (2)步骤B加热保温的作用是 . a有利于加快反应速度 b有利于未反应的硝酸挥发 c有利于硝酸充分反应,降低溶液中C(H ) (3) 步骤C是为了除去Fe3 ,Cu2 等杂质,冲稀静置时发生的化学反应是 a置换反应 b水解反应 c氧化—还原反应 产生的沉淀的化学式为 27、(13分) 某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验: (1)取样品ag,称取时使用的仪器名称为 . (2)将样品溶解于足量的稀盐酸中,过滤,滤液中主要含有 ,滤渣中含有 ;在溶解、过滤时使用的仪器有 . (3)往滤液中加入过量NaOH溶液,过滤.写出该步操作中有关的离子方程式 , , 。 (4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称重质量为bg.有关的化学方程式为 , . (5)该样品中铝的质量分数的表达式为 . (6)若第(3)步加入NaOH的量不足,会使测定结果(偏高、偏低、不影响) . 若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果(偏高、偏低、不影响) . 若第(4)步中对沉淀的灼烧不充分时,会使测定的结果(偏高、偏低、不影响) . 四、本题包括4小题,共16分 28.(4分)已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Z原子最外层电子数是次外层电子数的3倍。Y、Z之间可以形成多种化合物,有的是大气污染物,有的与水反应形成强酸;试推断: (1)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的化学式分别为: ; (2)由X、Y、Z所形成的离子化合物与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是 ; (3)由X、Y、Z所形成的离子化合物,其水溶液的PH小于7,原因是(用离子方程式表示) ; (4)X、Y形成的化合物液态时可发生电离(可由X、Z形成的化合物电离推知),写出电离方程式 。 29、(6分)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空: (1)写出下列物质的化学式: A: ,E: F: ,Y: 。 (2)反应⑤的化学方程式为: 。 (3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为: 。 30、(2分)海战中为了隐蔽,常喷射SiCl4和液氨,形成很浓的烟幕,写出有关的化学方程式。 31、(4分)某同学用0.1×10×25mm3、质量分数≥99.5%的铝片和酸反应制取H2,实验现象见下表
| 时间 酸
| 1min
| 2 min
| 5 min
| 15 min
| 20 min
| 3mol/LHCl
| 0.74
| 1.60
| 1.52
| 1.10
| 0.99
| 1.5mol/LH2SO4
| 均无明显现象(无气泡) | ||||||||||||||||||||||||||
(1)写出上述铝与酸反应的离子方程式 ;
(2)反应1~15 min内,铝与盐酸的反应速率逐渐加快,其原因是
;
(3)根据以上实验现象,可以作出哪些猜想?
猜想一: ;
猜想二: ;
……
六、本题包括2小题,共16分
32、(6分)如右图所示,将2molN2和6molH2混合置于体积不变的等压容器中,在一定温度下发生如下反应:N2(g) 3H2(g) ![]() 2NH3(g);(正反应为放热反应)。该反应达到平衡状态A时,测得气体总物质的量为5.6mol。
2NH3(g);(正反应为放热反应)。该反应达到平衡状态A时,测得气体总物质的量为5.6mol。
若N2、H2、NH3起始的物质的量分别用a、b、c表示,回答下列问题:
(1)在达到平衡状态A的容器中通入少量H2,体系中N2
的体积分数 (填“增大”或“减小”或“不变”),若要使N2的体积分数再变到与平衡状态A相同,可采取的措施有 或 。
(2)若起始时a=1mol,b=3mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的取值为 。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围为 。
33、(10分)现代生产硝酸最重要的方法是氨的催化氧化法,原料是氨气和氧气。这个方法的生产过程大致可分为三个阶段:a.氨催化氧化生成一氧化氮;b.一氧化氮氧化生成二氧化氮,二氧化氮被水吸收而生成硝酸和一氧化氮,一氧化氮反复循环使用可完全转化为硝酸;c.尾气的处理。
(1)理论上讲,欲使1体积氨气完全转化为硝酸,至少需要相同条件下的空气多少体积(假设空气中氮气和氧气的体积比为4:1重,氮气不参与反应)?
(2)若(1)中的化学反应是在密闭容器中进行的,则生成的硝酸溶液中硝酸的质量分数是多少?
(3)现以1mol氨气作原料合成硝酸铵,若氨气制硝酸的转化率是80%,氨气和硝酸是恰好完全反应的,则制得硝酸铵的物质的量最多是多少(mol)?
(4)在密闭容器中,NH3和O2的混合气体共amol,经充分反应后,生成硝酸的物质的量(y)与O2的体积分数(x)之间的关系是什么?
高二化学期末试卷
1、C 2、B 3、D 4、C 5、A 6、A 7、B 8、C 9、D 9、B 10、A
11、BC 12、A 13、C 14、B 15、D 16、A 17、CD 18、B 19、BC 20、AD
21、D 22、AB 23、AC 24、D 25、B
26、(1)稀 a.c (2) a.c (3) b ;Fe(OH)3 Cu(OH)2
27、(1)天平;(2)AlCl3、MgCl2;Cu、Si;烧杯、玻璃棒、漏斗、带铁圈的铁架台(或漏斗架)
(3)Mg2 2OH- ![]() Mg(OH)2↓ Al3 4OH-
Mg(OH)2↓ Al3 4OH- ![]() AlO-2 2H2O
AlO-2 2H2O
(4)NaAlO2 CO2 2H2O ![]() Al(OH)3↓ NaHCO3
Al(OH)3↓ NaHCO3
2Al(OH)3 ![]() Al2O3 3H2O
Al2O3 3H2O
(5) ![]() ×100% 设原合金中含铝xg,关系式:
×100% 设原合金中含铝xg,关系式:
2Al———Al2O3
![]() =
= ![]() x=
x= ![]() b 所以合金中铝的质量分数为
b 所以合金中铝的质量分数为 ![]() ×100%
×100%
(6)偏低 偏高 偏高 加入NaOH的量不足时,有一部分Al(OH)3没有转化为AlO-2而损失,导致b值偏小,从而使测定结果偏低.
若不用蒸馏水洗涤沉淀,沉淀上会附有杂质,导致b值偏大,使测定结果偏高.若对Al(OH)3灼烧不充分时,有一部分Al(OH)3混入Al2O3中,导致b值偏大,使测定结果偏高.
28、⑴NH3、Na2O、Na2O2、Na3N、NaH(任写其中三种)
![]()
⑵NH4 OH— NH3↑ H2O
⑶NH4 H2O ![]() NH3·H2O H
NH3·H2O H
⑷NH3 NH3 ![]() NH4 NH2—
NH4 NH2—
29、(1)H2O 、N2 、Ag 、HCl;(2)4NH3+5O2==4NO+6H2O ;
(3)AgN3
30、SiCl4 4H2O==4HCl H4SiO4 NH3 HCl==NH4Cl
31、⑴2Al 6H =2Al3 3H2↑
⑵该反应为放热反应,温度升高,反应速率加快。
⑶Cl—对该反应起催化作用,能加快该反应的速率;SO42—对反应起阻碍作用。32、⑴减小,通入适量的N2,升高温度;⑵任意值⑶2.4<c≤4
33、⑴10体积;⑵77.8%;⑶0.44mol;
⑷0<x≤5/9,y=0;5/9<x<2/3,y=3ax—5/3a;x≥2/3,a—ax。
| |