|
《电离平衡》复习练习二 班级 姓名
一、选择题:
( )1.给蒸馏水中滴入少量盐酸后,下列说法中错误的是
(A)[H ][OH- ]乘积不变 (B)pH增大了
(C)[OH- ]降低了 (D)水电离出的[H ]增加了
( )2.下列叙述中正确的是
(A)使甲基橙试液变黄色的溶液一定是碱性溶液
(B)使酚酞试液变红色的溶液一定是碱性溶液
(C)使甲基橙试液变红色的溶液一定是酸性溶液
(D)使紫色石蕊试液不变色的溶液一定是中性溶液
( )3.下列试纸使用时, 不宜先用水润湿的是
(A)pH试纸 (B)红色石蕊试纸
(C)淀粉碘化钾试纸 (D)蓝色石蕊试纸
( )4.常温下pH=3的二元弱酸H2R溶液与VLpH=11的NaOH溶液混合后,混合液pH=7。下列判定正确的是
(A)溶液总体积为2VL (B)溶液中[R2-]>[Na ]>[H ]=[OH-]
(C)溶液中[R2-]>[OH-] =[Na ] H ] (D)溶液中2[R2-] [HR-]=[Na ]
( )5.准确量取25.00mL高锰酸钾溶液,可选用的仪器是
(A)50mL 量筒 (B)10mL量筒
(C)50mL 酸式滴定管 (D)50mL碱式滴定管
( )6.已知常温、常压下,饱和CO2的水溶液的pH=3.9,则可推断用标准盐酸溶液滴定碳酸氢钠水溶液时,适宜选用的指示剂及滴定终点时颜色变化的情况是
(A)石蕊,由蓝变红 (B)甲基橙,由橙变黄
(C)酚酞,红色褪去 (D)甲基橙,由黄变橙
( )7.进行中和滴定时,事先不应该用所盛溶液润洗的仪器是
(A)酸式滴定管 (B)碱式滴定管 (C)锥形瓶 (D)量筒
( )8.用已知浓度的强酸滴定未知浓度的强碱溶液时,会导致待测碱液浓度结果偏低的操作是
(A)锥形瓶用蒸馏水洗净后装待测液 (B)滴定管用蒸馏水洗净后注入标准液
(C)滴定前仰视读数, 滴定后俯视读数 (D)配制碱液时, 称量后固体吸湿
( )9.将pH= l的盐酸平均分成 2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
A. 9 B.10 C.11 D.12
( )10.pH=9 的Ba(OH)2溶液与pH=12的KOH溶液,按4︰1的体积比混合,则混合溶液中H 浓度为(单位:mol·L-1)
A. 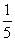 ×(4×10-9 1×10-12) B. ×(4×10-9 1×10-12) B. 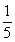 ×(8×10-9 1×10-12) ×(8×10-9 1×10-12)
C.5×10-10 D.5×10-12
( )11.pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是 .
A.11∶1 B.9∶1 C.1∶11 D.1∶9.
( )12. 欲使  的 的  溶液的 溶液的 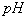 调整到7,下列试剂或方法不可行的是 调整到7,下列试剂或方法不可行的是
A. 加入 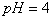 的溶液 B. 加入 的溶液 B. 加入 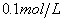 的盐酸 的盐酸
C. 加水稀释  倍 D. 加入饱和 倍 D. 加入饱和 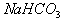 溶液 溶液
( )13.某元素X的相对原子质量为a,它的最高氧化物的水化物的分子式为HmXOn(m>1)。 下列有关叙述中一定正确的是
A.该酸的水溶液中,c(H+)∶c(XO 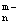 )=n∶1 )=n∶1
B.该酸的摩尔质量为(m+a+16n)g
C.100 mL该酸溶液,能中和4g NaOH
D.若0.1molL-1该酸溶液的pH=1,则NamXOn的水溶液的pH>7
二、填空题:
14.在95℃时,纯水的pH (填“大于”“小于”“等于”)7,所选择的理由是 。
15.将pH=3的弱酸溶液稀释100倍,该溶液的pH范围为:__________________。
16.有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
(1)假如加入蒸馏水,就加入________ mL
(2)假如加入pH = 10的NaOH溶液,应加入_________ mL
(3)假如加入0.008 mol/L HCl溶液,应加入__________ mL
17.某烧碱样品中含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
(A)在250mL的容量瓶中定容配制250mL烧碱溶液;
(B)用移液管移取25mL烧碱溶液于锥形瓶中,并滴入几滴甲基橙作指示剂;
(C)在托盘天平上准确称取烧碱样品Wg ,在烧杯中用蒸馏水溶解;
(D)将物质的量浓度为cmol·L-1的标准硫酸溶液装入已润洗过的酸式滴定管中,调整液面并记下起始读数为V1mL;
(E)在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数为V2mL。
就此完成下列问题:
(1)正确操作步骤是(用编号字母填空)___→____→____→D→____;
(2)观察滴定管里液面的高度时应注重:____________________。
(3)E步骤的操作中在锥形瓶下垫一张白纸的作用是____________________。
(4)D步骤的操作中液面应调整到___________________________________,尖嘴部分应该________________________。
(5)某学生实验时把锥形瓶用待测烧碱溶液润洗,则测定的烧碱溶液的浓度偏高还是偏低________;其原因是_______________________________________________。
(6)该烧碱样品纯度的计算公式是________________________。
三、计算题:
18.250 mL pH=12的某一元强碱(MOH)溶液与250 mL 0.025 mol·L-1 的硫酸溶液相混合, 假设混合后液体体积为500 mL。试求:
(1)混合液的pH;
(2)若原250 mL一元强碱中含溶质0.1 g, 则M的相对原子质量为多少?
(3)若给混合液中分别滴入几滴甲基橙、无色酚酞、紫色石蕊试液,则溶液的颜色分别是什么?
《电离平衡》复习练习二 答案
一、选择题: |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 | |
BD |
BC |
A |
D |
C |
D |
C |
C |
C |
D |
D |
CD |
D | |