|
氧族元素练习题(二)
班级_______姓名________得分________
1. 常温下,H2S与O2两气体混和,充分燃烧后H2S无剩余,恢复到原来的状态时,所得SO2的气体体积是原H2S气体体积的三分之一。则原H2S与O2的体积比是:
A. 1︰3 B. 6︰5 C. 5︰6 D. 4︰3
2. 在常温常压下,24毫升H2S和O2的混和气点火燃烧,生成6毫升SO2时,则原混和气体中H2S的体积为:
A. 6毫升 B. 12毫升 C. 15毫升 D. 18毫升
3. 在常温、常压下将a升SO2和b升H2S混和,当反应后气体体积是反应前气体体积的四分之一时,则a与b之比为:
A. 1︰1 B. 1︰2 C. 1︰3 D. 2︰1
4. 在体积可变的密闭容器中,将等体积的H2S和SO2在常温常压下混合,充分反应后,气体体积与反应前气体体积之比为:
A. 1/2 B. 1/4 C. 小于1/4 D. 大于1/4
5. 将H2S和O2的混和气体,在120℃的温度下,装入密闭容器中,在高温下使之反应。已知全部的H2S和O2都参加了反应,反应后测得压强为反应前的3/4倍,则原混和气体中H2S和O2的物质的量之比为:
A. 1︰1 B. 1︰2 C. 2︰1 D. 3︰2
6. 标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是:
A. H2S、SO2 B. O2 C. H2S D. SO3
7. 含有元素硒(Se)的保健品现在已开始进入市场,下列关于硒的叙述错误的是:
A. 最高价氧化物的化学式为SeO3 B. 原子序数为24
C. 气态氢化物的化学式为H2Se D. 非金属性比溴弱
8. 在用接触法制硫酸的过程中,若将接触室内混合气体忽然冷却到150℃,有白色晶体析出,此晶体是:
A. 硫酸酐 B. 固态氧 C. 亚硫酸酐 D. 硫黄
9. 将三氧化硫溶解在硫酸中所得到的混合物叫做“发烟硫酸”,通常以三氧化硫的质量分数表示其组成。今将0.1185g发烟硫酸试样溶于水,用0.125mol/L的NaOH标准溶液滴定。用去此标准溶液20mL恰好中和,则试样中SO3的质量分数为:
A. 15% B. 17% C. 34% D. 60%
10. 将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。假如把含H2S的气体通入CuSO4溶液,导电性稍有变化但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化很大。现要测量空气中的含氮量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是:
A. NaOH溶液 B. 蒸馏水 C. Na2SO3溶液 D. KI溶液
11. 工业上从含硒废料中提取硒的方法是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸即转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),再通入SO2于亚硒酸的溶液中,单质硒析出,据此下列叙述正确的是:
A. H2SeO4的氧化性强于Cl2 B. 亚硒酸的氧化性强于亚硫酸
C. SeO2还原性强于SO2 D. 析出1mol硒,消耗1mol SO2
 12. 保险粉是连二亚硫酸钠(Na2S2O4)的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入SO2气体,所发生的化学反应是:HCOONa+2SO2+NaOH=Na2S2O4+CO2+H2O,以下有关叙述中错误的是: 12. 保险粉是连二亚硫酸钠(Na2S2O4)的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入SO2气体,所发生的化学反应是:HCOONa+2SO2+NaOH=Na2S2O4+CO2+H2O,以下有关叙述中错误的是:
A. 在此反应中,HCOONa是还原剂,SO2是氧化剂
B. 保险粉的还原性比HCOONa的还原性强
C. NaOH未被氧化也未被还原
D. 甲醇虽未参加反应,但有助于保险粉的结晶、分离
13. 将绿矾晶体加热,除失去结晶水外,还发生下列反应:2FeSO4=Fe2O3+SO2↑+SO3↑。若将该反应的气体通入氯化钡溶液,则有:
A. 硫酸钡沉淀 B. 亚硫酸钡沉淀 C. SO2气体逸出 D. SO2气体逸出
14. As2S3和As2O3的性质相似,均有还原性;Na2S2和Na2O2的性质相似,均有氧化性,当As2S3与Na2S2相互反应时,生成的盐是:
A. Na3AsS4 B. Na2AsS3 C. Na3AsS3 D. Na2AsS4
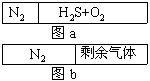
15. 在20℃时一刚性容器内部有一不漏气且可滑动的活塞将容器分隔成左、右室两室。左室充入N2,右室充入H2S和O2,活塞正好停留离左端1/4处(如右图a)然后点燃H2S和O2,反应完毕恢复至原来温度,活塞恰好停在中间(如右图b),水蒸气的体积可忽略,则反应前H2S和O2的体积比可能是:
A. 1︰1 B. 4︰5 C. 5︰4 D. 7︰2
16. 今有A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与C、B与D分别是同族元素,B、D两元素的质子数之和是A、C两元素质子数之和的两倍,这四种元素中有一种元素的单质易溶于二硫化碳,则这四种元素分别是:
A 、B 、C 、D 。
17. 某热电厂地处多雨地带,使用的燃料煤中含有少量的硫,燃烧的气体未经处理即排放到空气中,又有部分发电用水未经冷却排入四周的河中,经观察其下游几十公里范围内的河水中鱼类几乎绝迹,试解释出现这种现象的原因。
18. 工业上制取CuSO4不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断由容器的下部吹入细小的空气泡,试分析这种制备办法的优点。
19. 为降低硫的氧化物对空气的污染,可把氧化钙和含硫的煤混和后燃烧,这种方法叫做钙基固硫,试写出有关的化学方程式 。
20. 在2FeS+6H2SO4(浓)  Fe2(SO4)3+3SO2↑+2S↓+6H2O反应中, 是还原剂,氧化产物和还原产物的质量比为 。 Fe2(SO4)3+3SO2↑+2S↓+6H2O反应中, 是还原剂,氧化产物和还原产物的质量比为 。
21. 将等物质的量的Cl2和SO2气体通入滴有石蕊试液的BaCl2溶液中,出现的现象是 。
22. 把1克含脉石(SiO2)的黄铁矿样品在空气中灼烧,反应后得残渣0.78克,此黄铁矿的纯度是 。
23. 某氧化剂中,起氧化作用的是X2O72-,在溶液中0.2mol的该离子恰好能使0.6mol的SO32-完全氧化,则X2O72-被还原后元素X的化合价为 。
24. 某亚硫酸钠已部分被氧化成硫酸钠,经测定该混和物含硫25%,则混和物中亚硫酸钠与硫酸钠的物质的量之比为 。
25. 在FeSO4、Fe2(SO4)3、BaSO4、Al2(SO4)3的混和物中,氧元素含量的质量百分比为a%,试求含硫元素的质量百分比及Fe,Ba,Al三元素质量的总和占混和物质量的百分比。
26. 足量的浓硫酸中加入a克铜,完全反应放出b升气体;足量的稀盐酸中加入m克FeS,完全反应放出n升气体(气体体积均在标况下测定)。已知两者生成的气体正好完全反应,则a︰m︰b︰n= 。
27. 红热的炭与浓硫酸可发生反应。反应方程式如下:
C + 2H2SO4(浓)  CO2↑ + 2SO2↑ + 2H2O CO2↑ + 2SO2↑ + 2H2O
(1)用“双线桥”标出该反应中电子的转移的方向和数目,并回答下列问题:
①还原产物和氧化产物的质量比是 ;
②写出CO2的结构式 ;
③三个产物中属于非极性分子的是 。
(2)现欲设计一个实验以验证此反应所生成的各种产物。实验中可供使用的试剂有:浓硫酸、稀硫酸、澄清石灰水、NaOH溶液、Ba(OH)2溶液、品红溶液、紫色石蕊试液、酸性高锰酸钾溶液、无水硫酸铜固体、碱石灰和无水氯化钙固体。有一个同学按气体的流动方向设计了一个实验过程,其所使用的试剂次序可表示为:
气体产物→试剂Ⅰ→试剂Ⅱ→试剂Ⅲ→试剂Ⅱ→试剂Ⅳ
①试剂Ⅰ、Ⅱ、Ⅲ、Ⅳ分别为__________,__________,_________,________;
②说出试剂Ⅱ使用两次的作用分别是:
_____________________________,__________________________________;
③写出气体产物通过试剂Ⅳ时的离子方程式 .
28. 由常见元素组成的化合物A、B、C、D、E、F有如图所示的关系,其中C、F、G是无色的,D是氯化物。
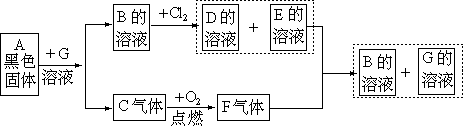
试确定A、B、C、G物质的化学式:
A ,B ,C ,G
29. 在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
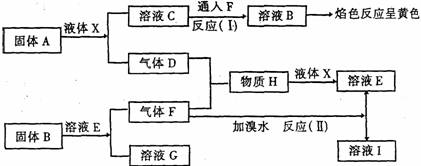
(1)固体A、B的化学式分别是 、 。
(2)分别写出反应(Ⅰ)、(Ⅱ)的离子方程式 、 。
30. 有一亚硫酸钠,可能已经变质。现将亚硫酸钠试样烘干后,称取a克,用蒸馏水溶解,加足量硝酸钡溶液,滤出生成的沉淀,洗净、干燥,得沉淀b克,试写出下列三种情况b与a的关系式:
(1)当亚硫酸钠没有变质时 ;
(2)当亚硫酸钠部分变质时 ;
(3)当亚硫酸钠完全变质时 。
[1] B
[1] A、B
[1] A、C
[1] C
[1] A
[1] C
[1] B
[1] A
[1] A
[1] C
[1] A、B
[1] B
[1] A、D
[1] A
[1] AC
[1] 氢 氧 钠 硫(A、C也可以分别是氦、氩)
[1] 煤燃烧后,硫转化成二氧化硫气体,形成酸雨使何水酸度增大,排出的热水又使河水的温度升高,O2的溶解度降低,鱼类在这种环境中无法生存而绝迹
[1] 这种办法的优点主要有两处︰一是不产生污染空气的二氧化硫,二是提高了硫酸的利用率
[1] S+O2=SO2 2CaO+2SO2+O2=2CaSO4
[1] FeS 29︰12
[1] 产生白色沉淀,试液变成红色
[1] 66%
[1] +3
[1] 7︰1
[1] 0.5a% 1-1.5a%
[1] 4︰11︰7︰14
[1] (1)4e ①11︰32 ②O=C=O ③CO2 (2)①无水硫酸铜固体 品红溶液 酸性KMnO4溶液 澄清石灰水 ②检验气体产物中是否有SO2 确认SO2气体已被除完 ③Ca2++CO2+2OH-=CaCO3↓+H2O
[1] FeS FeSO4 H2S H2SO4
[1] (1)Na2O2 Na2SO3(各2分) (2)2OH-+SO2=SO32-+H2O SO2+Br2+2H2O=4H++SO42-+2Br-(各2分)
[1] (1)a=126b/217 (2)126b/217<a<142b/233 (3)a=142b/233
|