| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
|
| 熔点
| 沸点
| 三氯化磷
| -112℃
| 76℃
| 五氯化磷
| 148℃
| 200℃(分解) |
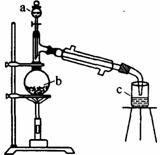
|
a |
|
c |
|
d |
|
e |
|
g |
|
b |
|
CaCl2 |
|
f |

(1)有浓盐酸、浓硫酸、白磷、二氧化锰、氢氧化钠等物质供选用,a、b中应该装入的试剂分别是a_____________、b______________。
(2)需要加热的仪器有___________ (填字母)。
(3)生成的三氯化磷在蒸馏烧瓶e中收集,为保证三氯化磷蒸汽冷凝,应在水槽g中加入________________。
(4)三氯化磷遇水蒸气强烈反应,甚至爆炸。所以d、e仪器以及装入的物质都不能含有水分。为除去氯气中的水分,C可以装入下列物质中的___________(填字母)。
A 碱石灰 B 浓硫酸 C 无水氯化钙
(5)氯气和白磷反应放出大量的热,为使仪器d不致因局部过热而炸裂,实验开始前应在曲颈瓶的底部放少量________________。
(6)实验室的白磷保存在水中,取出白磷后用滤纸吸干表面的水分,浸入无水酒精中片刻再浸入乙醚中片刻即可完全除去水分。已知水与酒精互溶,酒精与乙醚互溶。用上述方法完全除去水分的原理是_________________。
(7)为防止氯气污染空气,装置末端导出的气体最好用(填字母)________进行净化处理。
A NaOH溶液 B Ca(OH)2溶液 C 饱和食盐水
[vii].测定铵盐中氮含量的经典方法是:将NaOH与NH4+离子作用,产生的氨气通入盐酸溶液中被吸收,当吸收完全后,以0.1%甲基红为指示剂,用标准氢氧化钠溶液滴定剩余的盐酸,从而计算出氮的含量。用上述方法测定氮含量有两点不太理想:第一点是氨溶于盐酸中生成氯化铵,其溶液是无色的,不能直观地看到氨气是否被盐酸吸收;第二点是采用甲基红为指示剂,其pH变色范围较宽(Ph=4.4~6.2),判定终点不太灵敏,轻易带来误差。后改用新的分析方法,即:用硼酸为氨的吸收液,0.1%的亚甲基蓝和0.1%的甲基红的混合液为指示剂(变色范围pH=5.2~5.6,酸性时为红紫色,碱性时为绿色),用标准盐酸滴定上述吸收了氨的混合液,求出氮的含量。
 根据新的分析方法,回答下列问题:
根据新的分析方法,回答下列问题:
(1)若用如右图的装置使NH4Cl与NaOH反应放出氨气,则a中应放的药品是________,b中应放的药品是________,c中应放入 和 。
(2)硼酸吸收液从 色变到 色时表示有氨被吸收。
(3)用标准盐酸滴定硼酸吸收液时,是否要再另加指示剂?答: 。
(4)新方法的主要优点是:
[i] (1)溶液变蓝色,烧瓶内气体由无色继而变成红色,气球胀大 (2)①CD ② 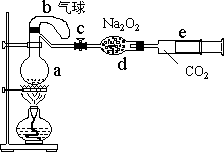 ③4NO2+O2+2H2O=4HNO3或4NO+3O2+2H2O=4HNO3 有一部分被吸入烧瓶 ④38.4 ⑤2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
③4NO2+O2+2H2O=4HNO3或4NO+3O2+2H2O=4HNO3 有一部分被吸入烧瓶 ④38.4 ⑤2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
[ii](1)1,4,5,8,9,6,7,2(8和 9可颠倒) (2)驱赶装置中的空气,防止反应产生的NO被氧化 (3)通入O2后装置D中有红棕色气体生成 (4)分离NO和NO2 (5)4NO2+O2+4NaOH=4NaNO3+2H2O
[iii] (1)排尽整个装置中的空气;防止生成的NO被氧化,而在D中观察不到现象。 (2)吸收所流中的水蒸气。 (3)无色气体变为红棕色 热 由题意可知2NO2 ![]() N2O4是放热反应,升高温度可使平衡向吸热方向(逆向)移动,无色的N2O4减少,红棕色NO2增多,便于观察。(或降温可使平衡正向移动,无色N2O4增多,NO2减少,不易观察到红棕色 (4)打开K1、K2持续通入一段时间的N2和O2 (5)装置C中烧瓶在实验前后增加的质量 (6)向反应后的混合溶液中加入过量的NaCl溶液,过滤、洗涤、干燥沉淀,称量生成的AgCl沉淀质量,然后进行计算。(其它合理答案均给分)
N2O4是放热反应,升高温度可使平衡向吸热方向(逆向)移动,无色的N2O4减少,红棕色NO2增多,便于观察。(或降温可使平衡正向移动,无色N2O4增多,NO2减少,不易观察到红棕色 (4)打开K1、K2持续通入一段时间的N2和O2 (5)装置C中烧瓶在实验前后增加的质量 (6)向反应后的混合溶液中加入过量的NaCl溶液,过滤、洗涤、干燥沉淀,称量生成的AgCl沉淀质量,然后进行计算。(其它合理答案均给分)
[iv] (1)改用铜粉或微热或加热 (2)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 试管内有空气存在,将生成的NO氧化为NO2(或2NO+O2=2NO2) 由于碳酸盐与硝酸反应速率快,生成的CO2排走了试管内的空气 (3)①③ (4)③ NaOH溶液 蒸馏水
[v] (1)生成的NO2溶解在水中:3NO2+H2O=2HNO3+NO (2)生成的NO具有较强的还原性,它被浓硝酸氧化:2HNO3+NO=3NO2+H2O
[vi] (1)浓盐酸,二氧化锰 (2)b (3)冰水 (4)C (5)细沙 (6)相似相溶原理 (7)A
[vii] (1)NaOH NH4Cl 硼酸 混合指示剂 (2)红色 绿色 (3)不要 (4)①能看到氨被吸收的现象 ②指示剂变色范围窄、灵敏度高、准确性好
| |