|
化学反应速率和化学平衡单元练习
一、选择题
1.一定温度下,向一容积为2 L的真空密闭容器中(事先装入催化剂)通入1 mol 氮气和3 mol氢气。3 min后测得容器内氮气的物质的量为0.8 mol。在此时间内, 用氢气的量的变化来表示该反应的平均速率  是 是
A. 0.6 mol/(L·min) B. 0.3 mol/(L·min)
C. 0.2 mol/(L·min) D. 0.1 mol/(L·min)
2.在等温、等容条件下有下列气体反应:2A(气)+2B(气)  C(气) 3D(气)。现分别从两途径建立平衡:I A和B的起始浓度均为2mol/L;II C和D的起始浓度分别为2 mol/L和6mol/L。下列叙述正确的是 C(气) 3D(气)。现分别从两途径建立平衡:I A和B的起始浓度均为2mol/L;II C和D的起始浓度分别为2 mol/L和6mol/L。下列叙述正确的是
A.I和II两途径最终达到平衡时,体系内混合气体的体积分数相同
B.I和II两途径最终达到平衡时,体系内混合气体的体积分数不同
C.达平衡时,I途径的反应速率等于II途径的反应速率
D.达平衡时,I途径混合气体密度为II途径混合气体密度的1/2
3.向4 L容器中充入0.7 mol SO2和0.4 mol O2,4 s末测得剩余SO2是0.3 mol,则u(O2)为
A. 0.100 mol /(L·min) B. 0.025 mol /(L·s)
D. 0.050 mol /(L·min) D. 0.0125 mol /(L·s)
4.勒沙特列原理是自然界一条重要的基本原理, 试运用此原理分析:氯化银在下列溶液中溶解度最少的是
A. 饱和食盐水 B. 0.1 mol/L的盐酸
C. 0.1 mol/L的CaCl2溶液 D. 新制的饱和氯水
5.将气体A2和B2等物质的量注入容积为1 L的密闭容器中反应生成C,平衡时测得c(A2)=0.58 mol/L,c(B2)=0.16 mol/L,c(C)=0.84 mol/L,则C的分子式为
A. AB B. A2B C. AB2 D.A2B3
6.在容积为1 L的固定真空容器中,加入3.68 g N2O4无色晶体,升温至20℃,晶体逐渐气化成无色气体,并部分离解为红棕色的NO2气体,直至达到化学平衡:N2O4(g)  2N2O4(g)(正反应为吸热反应),从化学反应刚发生直到化学平衡的全过程中,以下量的变化正确的是(温度不变) 2N2O4(g)(正反应为吸热反应),从化学反应刚发生直到化学平衡的全过程中,以下量的变化正确的是(温度不变)
A. 气体总压强减小 B. 气体平均相对分子质量减小
C. 气体的密度增大 D. 气体的密度减小
7.在一定体积和一定条件下有反应N2 3H2 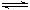 2NH3,现分别从两条途径建立平衡:I.起始浓度N2 1mol/L,H2 3mol/L,II.起始浓度N2 2mol/L,H2 6mol/L,下列叙述正确的是 2NH3,现分别从两条途径建立平衡:I.起始浓度N2 1mol/L,H2 3mol/L,II.起始浓度N2 2mol/L,H2 6mol/L,下列叙述正确的是
A.I和II两途径达到平衡时,体系内各成分的体积分数相同
B.达到平衡时,I途径的反应速率v(H2)等于II途径的反应速率v(H2)
C.达到平衡时,I途径体系内混合气体的密度为途径II的1/2
D.达平衡时,II途径体系内混合气体的压强是I途径的2倍
8.对于一可逆反应,当确知平衡向正反应方向移动,下列说法正确的是
A. 反应物的转化率将提高 B. 生成物的产量将增加
C. 生成物的浓度将增大 D. 生成物的百分含量将增大
9.在一个固定容积的密闭容器中,加入m mol A、n mol B发生下列反应:mA(g)+nB(g)  pC(g),平衡时C的浓度为W mol/L。若维持容器体积和温度不变,起始时放入a mol A、b mol B、c mol C,要使平衡后的浓度仍为W mol/L,则a、b、c必须满足的关系是 pC(g),平衡时C的浓度为W mol/L。若维持容器体积和温度不变,起始时放入a mol A、b mol B、c mol C,要使平衡后的浓度仍为W mol/L,则a、b、c必须满足的关系是
A. a∶b∶c=m∶n∶p B. a∶b=m∶n; 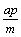 +c=p +c=p
C. 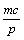 +a=m; +a=m;  +b=n D. a= +b=n D. a= 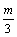 ;b= ;b= 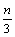 ;c= ;c= 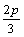
10.密闭容器中进行的反应为 X(g)+3Y(g)  2Z(g),X、Y、Z 的起始浓度依次为0.1 mol / L,0.3 mol / L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是 2Z(g),X、Y、Z 的起始浓度依次为0.1 mol / L,0.3 mol / L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是
A. X=0.2 mol / L,Y=0.6 mol / L B. Y=0.5 mol / L或Y=0.1 mol / L
C. Y=0.3 mol / L D. Z=0.4 mol / L
11.在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入 a mol及b mol碘化氢(a>b),待反应2HI  I2 (g)+H2(g) 达平衡后,下列说法肯定正确的是 I2 (g)+H2(g) 达平衡后,下列说法肯定正确的是
A. 从反应开始到建立平衡所需时间:tA<tB
B. 平衡时I2的浓度:c(I2)A = c(I2)B
C. 平衡时碘蒸气在混合气体中的百分含量:A容器中的大于B容器中的
D. 平衡时HI的分解率:αA = αB
12.在一固定容积的密闭容器中充入1 mol N2和3 mol H2,在催化剂存在下建立如下平衡:
 N2+3H2 2NH3 N2+3H2 2NH3
测得平衡时H2的体积分数为 a%,在维持温度不变的条件下,再向上述平衡体系中充入1mol NH3,待新平衡建立后,测得H2的体积分数为b%,则a与b的关系为
A. a<b B. a=b C. a>b D. 无法判定
13.在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下变化:
CO(g)+H2O(g)  CO2(g)+H2(g)若反应达平衡时测得CO转化率为21.75%,则平衡混合气体的密度为相同条件下H2 密度的 CO2(g)+H2(g)若反应达平衡时测得CO转化率为21.75%,则平衡混合气体的密度为相同条件下H2 密度的
A. 5.75倍 B. 11.5倍 C. 30.67倍 D. 46倍
14.次氯酸是比碳酸还弱的一种酸,当反应Cl2+H2O(l)  HCl(l)+HClO(l) 达平衡后,为了增大溶液中HClO的浓度,应采取的措施是 HCl(l)+HClO(l) 达平衡后,为了增大溶液中HClO的浓度,应采取的措施是
A. 加入CuCO3固体 B. 加入NaOH固体
C. 加水 D. 加压
15.反应2A(g)  B(g)+xC(g)在一定条件下达到平衡后,容器内压强增大了p%,A的转化率为p%,则x的值为 B(g)+xC(g)在一定条件下达到平衡后,容器内压强增大了p%,A的转化率为p%,则x的值为
A. 1 B. 2 C. 3 D. 4
15.当密闭容器中反应mA(g)+nB(s)  pC(g)已经达到平衡后,将密闭容器的体积缩小,发现A的转化率也随之降低。那么,下列几个表示化学方程式化学计量数关系的式子中, 普遍适用于上述一类反应的是 pC(g)已经达到平衡后,将密闭容器的体积缩小,发现A的转化率也随之降低。那么,下列几个表示化学方程式化学计量数关系的式子中, 普遍适用于上述一类反应的是
A. m+n>p B. m+n<p C. m>p D. m<p
16.某温度下,X(g)+Y  2Z反应达到平衡,在升高温度或减小压强的情况下,平衡向右移动,则下列有关反应的各种叙述中正确的是 2Z反应达到平衡,在升高温度或减小压强的情况下,平衡向右移动,则下列有关反应的各种叙述中正确的是
A. 正反应是吸热反应,Z是固体
B. 逆反应是放热反应,Y是固体,Z为气体,Y的转化率增大
C. 正反应是吸热反应,只有Y不是气体,X转化率减小
D. 正反应是放热反应,Y和Z均为气体,X转化率增大
17.对于一定条件下的可逆反应:N2+3H2  2NH3,能说明反应已达平衡状态的是 2NH3,能说明反应已达平衡状态的是
A. 百分组成 NH3%=N2% B. c(NH3)不变
C. 压强不变 D. c(H2)∶c(N2)∶c(NH3)=3∶1∶2
18.在体积固定不变的密闭容器中,充入2 mol NO和1 mol O2,在一定条件下达到平衡时,NO的转化率为95%,此时容器内压强与开始时的压强之比是
A. 等于  B. 小于 B. 小于  C. 大于 C. 大于  D. 等于 D. 等于 
19.在一密闭容器,aA(g)  bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
20.能增加气体反应中反应物分子中活化分子的百分数的是
A. 升高温度 B. 使用催化剂
C. 增大压强 D. 增加浓度
21.在t℃时,将0.2 mol X和0.8 mol Y充入密闭容器中,当反应X(g)+Y(g)  nZ(g)+R(g)达到平衡时,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,并知c(X) c(Y)=c(Z)n c(R),则X的转化率为 nZ(g)+R(g)达到平衡时,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,并知c(X) c(Y)=c(Z)n c(R),则X的转化率为
A. 80% B. 65% C. 45% D. 37%
22.已知298K时2SO2(g) O2(g) 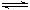 2SO3(g);△H=-197 kJ/mol,在相同温度下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1,向另一体积相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2,则下列关系正确的是 2SO3(g);△H=-197 kJ/mol,在相同温度下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1,向另一体积相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2,则下列关系正确的是
A.2a2=a1=197 kJ B.2a2<a1<197 kJ
C.a2>a1>197 kJ D.a1=a2>197 kJ
23.加热装有1 mol HI气体的定容密闭容器,发生反应: 2HI(g) 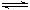 H2(g)+I2(g);△H>0,在t1 ℃反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2 molHI,在t2 ℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是 H2(g)+I2(g);△H>0,在t1 ℃反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2 molHI,在t2 ℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是
A.若t1=t2,则x1=x2 B.若t1=t2,则x1<x2
C.若t1<t2,则x1=x2 D.若t1<t2,则x1<x2
24.将1摩SO2和1 摩O2通入一体积不变的密闭容器中,在一定温度下发生如下反应:2SO2 O2  2SO3,反应达平衡时SO3为0.3摩。此时若移走0.5摩的O2和0.5摩的SO2,则反应达新平衡时SO3的物质的量是 2SO3,反应达平衡时SO3为0.3摩。此时若移走0.5摩的O2和0.5摩的SO2,则反应达新平衡时SO3的物质的量是
A.0.3摩 B.0.5摩
C.大于0.15摩,小于0.3摩 D.小于0.15摩
二、填空题
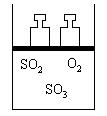 1.如右图所示将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g) O2(g) 1.如右图所示将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g) O2(g)  2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题: 2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题:
(1)在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数_________(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:____________或______________。
(2)若起始时a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的取值为___________。
(3)若要使反就开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是____。
2.有两只密闭容器A和B,A容器有一个移动的活塞,能使容器内保持恒压,B容器保持恒容,起始时向这两只容器中分别充入等量的体积比为1:2的SO2和O2的混合气体,并使A和B的容积相等。在保持400℃的条件下,使之发生反应:2SO2(g) O2(g)  2SO3(g),填写下列空格: 2SO3(g),填写下列空格:
(1)达到平衡时所需的时间A比B ,A中SO2的转化率比B 。
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,则A容器中化学平衡 移动,B容器中化学平衡 移动。
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中SO3的体积分数 (填增大、减小或不变),B容器中SO3的体积分数 (填增大、减小或不变)。
3.在恒温时,向某密闭容器中通入2molX和1molY气体,发生如下反应:
2X(g) Y(g) 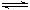 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中能入4molX(g)和2molY(g),达到平衡时,则Z的体积分数为______________;平衡时,气体总的物质的量是_____________;
(2)与上述平衡保持同温、同压,若向密闭容器中通入X(g)和Y(g)的物质的量分别记为n(X)和n(Y),并满足平衡时Z的体积分数为0.4,则n(X):n(Y)的取值范围是___________________。
4.在如图所示的三个容积相同的三个容器①、②、③进行如下的反应:
3A(g) B(g) 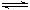 2C(g);△H=Q kJ/mol (Q<0) 2C(g);△H=Q kJ/mol (Q<0)

(1)若起始温度相同,分别向三个容器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号) ;
(2)若维持温度不变,起始时②中投入3 mol A、1 mol B;③中投入3 mol A、1 mol B和2 mol C;且保持②、③起始时压强相同,则达到平衡时,两容器中B的转化率② ③(填<、>、=);
(3)起始时在②中投入3 mol A和1 mol B,在③中投入a mol A和b mol B及c mol C,若达平衡时②和③压强恰好相同,且欲使达平衡时两容器内C的百分含量相等,则两容器中起始投料必须满足(用含a、b、c的关系式表达) 。
5.(6分)可逆反应2A(g)+nB(g)  mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下, mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下,
测得C的量与时间的关系如右图。
根据图分析,P1、P2的大小关系为 ____________;反应式中系数m和n的关系是__________________;
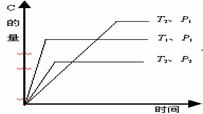 该反应的逆反应是_____热反应。 该反应的逆反应是_____热反应。
6.(4分)可变的密闭容器中盛有适量N2、H2混合气体,在一定条件下反应:N2 (g)+3H2(g)  2NH3(g),进行到2 min时达到平衡,此时容积为V L, 混合气体中氨气占体积的20%,若维持温度和压强不变,请回答: 2NH3(g),进行到2 min时达到平衡,此时容积为V L, 混合气体中氨气占体积的20%,若维持温度和压强不变,请回答:
(1) 原N2、H2混合气体为___________L;
(2) 假定以L / min为单位,则以H2表示的该反应的平均速率是_______________;
7.(5分)对于反应 xA(g)+B(s) 
yC(g)+D(s),A的百分含量与外压强有如下图的关系,
(容器体积、温度不变)则:
(1) P点左面曲线表示为_______________________
_____________________________________;
(2) x _____y (填“<”、“=”或“>”),其理由是:
_______________________________________
_____________________________________。
24.(8分)常温、常压下,A、B、C、D均为气态。A与B可发生可逆反应:A+B  C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中。在不同条件下达平衡时,C的浓度如下: C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中。在不同条件下达平衡时,C的浓度如下: |
温度 T/ ℃ |
压强 p/ Pa |
C平衡浓度 c/(mol·L-1) | |
25 |
1×105 |
1.0 | |
25 |
2×105 |
1.8 | |
25 |
4×105 |
3.2 | |
25 |
5×105 |
6.0 | |