|
普通高中毕业会考化学试题
化 学 试 卷
(考试时间:90 分钟;满分:100 分)
本试卷分为第I 卷和第II卷两部分,全卷共8页
可能要用到的相对原子质量:C-12 O-16 S-32 Ba-137
第I 卷(选择题共50 分)
注重事项:(1)答第I 卷前,考生务必用蓝、黑墨水钢笔或圆珠笔将自己的姓名、准考证号、考试科目等填写在答题卡上,考试结束时,由监考人员将试卷和答题卡一并收回。
(2)每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案,不能答在试卷上。
一、选择题(本大题包括25 个小题,每小题2 分,共50 分。每小题只有1 个选项符合题意)
1.碘缺乏会使人的智力低下,消除碘缺乏最经济可行的方法是
A.食盐中加碘盐 B.服用含碘药片
C.大量食用海带 D.注射含碘药剂
2.某元素的两种同位素,它们的原子具有不同的
A.质子数 B.质量数
C.原子序数 D.电子数
3.28 14Si 元素位于周期表中
A.三周期IVA 族 B.二周期IVA 族
C.三周期VIA 族 D.二周期VIA 族
4.下列物质中属于合金的是
A.水银 B.钢
C.金 D.银
5.用酒精消毒的原理是
A.溶解作用 B.还原作用
C.盐析作用 D.变性作用
6.空气中含量最多的气体是
A.O2 B.H2
C.N2 D.稀有气体
7.下列气体中,不能用排空气法收集的是
A.CO2 B.H2
C.NO2 D.NO
8.浓硝酸应避光保存是因为它具有
A.强氧化性 B.强酸性
C.挥发性 D.不稳定性
9.食品卫生与身体健康密切相关,下列做法中对人体健康不会造成危害的是
A.在沥青公路上翻晒粮食
B.肉类食品用福尔马林保鲜
C.竹笋用二氧化硫气体漂白
D.用小苏打做发酵粉
10.下列物质不属于油脂的是
A.花生油 B.润滑油
C.羊油 D.牛油
11.在SiO2 2C 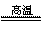 Si 2CO↑反应中,氧化剂是 Si 2CO↑反应中,氧化剂是
A.SiO2 B.C
C.Si D.CO
12.下列物质中,只含共价键的是
A.H2O B.NaOH
C.KBr D.NH4Cl
13.下列气体不能用浓硫酸干燥的是
A.SO2 B.CO2
C.NH3 D.HCl
14.A 、B 、C 都是金属,把A 、B 组成原电池时,A 为负极;把B 放人C 的盐溶液中,B 的表面附着一层金属C 。A 、B 、C 三种金属的活动性顺序为
A.A > C > B B.A > B > C
C.B > A > C D.C > B > A
15.检验氯化氢气体中是否混有Cl2,可采用的方法是
A.用干燥的蓝色布条
B.用干燥的蓝色石蕊试纸
C.将气体通人硝酸银溶液中
D.用湿润的碘化钾淀粉试纸
16.下列气体溶于水中发生了氧化还原反应的是
A.CO2 B.HCl
C.NO2 D.NH3
17.锂、钠、钾的化学性质相似的根本原因是
A.最外层电子数相同 B.原子半径相近
C.都能与酸反应产生氢气 D.都能与水反应生成碱
18.常温下铝具有较强的抗腐蚀性,主要原因是
A.铝不活泼
B.铝与氧气在常温下不反应
C.常温下铝表面能形成一层致密的氧化物薄膜
D.铝具有两性
19.浓硫酸不具有的性质是
A.与水混合放出大量的热 B.加热能与木炭反应
C.能与铁反应放出氢气 D.加热能与铜反应
20.在制水泥、玻璃和生石灰的生产中,都要用到的原料是
A.Na2CO3 B.SiO2
C.CaCO3 D.CaSO4
21.关于丙烯醛(CH2=CH-CHO )的叙述中,不正确的是
A.能发生银镜反应
B.与氢气加成只能生成丙醛
C.在一定条件下可氧化成酸
D.可使溴水褪色
22.下列物质不能与NaOH 溶液反应的是
A.乙醇 B.乙酸
C.乙酸乙醋 D.苯酚
23.下列离子方程式正确的是
A.钠和水反应:Na 2H2O=Na十+2OH-+H2↑
B.CO2 通人足量澄清石灰水中:Ca2 2OH-+CO2 = CaCO3↓+H2O
C.Fe 和盐酸反应:2Fe 6H+=2Fe3 +3H2 ↑
D.氧化铜溶于足量盐酸中:O2-+2H+=H2O
24.常温下,将等体积、等物质的量浓度的氨水和盐酸混合,混合后所得溶液
A.pH = 7 B.pH > 7
C.pH < 7 D.无法确定
25.向某溶液中滴人无色酚酞,溶液呈红色。下列离子在该溶液中一定能生成沉淀的是
A.Na B.Cl-
C.Fe3 D.SO42-
第II卷(非选择题共50 分)
注重事项:(l)用蓝、黑墨水钢笔或圆珠笔将答案直接写在试卷上。
(2)答卷前将密封线内的项目填写清楚。
二、填空·题(本题包括8个小题,每空1分,共28分)
26.选择造成下列环境问题的原因填空(填番号)。
(l)酸雨_______________。
(2)温室效应__________________。
(3)臭氧层被破坏______________。
(4)白色污染__________________。
(5)土壤污染________________。
A.空气中CO2浓度不断上升
B.大量使用塑料包装袋
C.工业上大量排放SO2
D.大量使用农药和化肥
E.大量使用氟里昂
27.1 mo1O2与1 molO3相比,所含分子数之比为___________,原子数之比为_________,同温同压下两种气体的体积之比为________________________。
28.在高温下,下列反应达到平衡:C ( s ) H2O ( g )  CO ( g ) H2 ( g ) (正反应为吸热反应)。假如升高温度,平衡向__________移动;假如增大压强,平衡向_________移动,假如增大水蒸气的浓度,平衡向_________移动。 CO ( g ) H2 ( g ) (正反应为吸热反应)。假如升高温度,平衡向__________移动;假如增大压强,平衡向_________移动,假如增大水蒸气的浓度,平衡向_________移动。
29.冶炼金属常用以下几种方法:
① 热分解法;② 热还原法;③ 电解法
请将适宜冶炼以下金属的方法的标号填写在该金属后面的横线上。
(l)铝______________
(2)铁_____________
(3)汞______________
30.在0.1 mol/L 的CH3COOH 溶液中,分别加人少量下列物质,请在下表中填写溶液
中c(H十)的变化。(填“增大”或“减小”或“不变”,)
|
加人物质{少量 |
浓HNO3溶液 |
少量NaOH固体 |
少量CH3COONa固体 |
|
c(H十)的变化 |
|
|
|
31.市售气体打火机中的气体主要成分是丁烷,丁烷的结构简式为__________________,
它的同分异构体的结构简式为____________________________,该同分异构体的名称为
____________________________________。
32.A、B、C、D 四种元素都是短周期元素。含有A 元素的物质,在火焰上灼烧产生黄色火焰;B2 是自然界中最轻的气体,B2在D2 中燃烧产生苍白色火焰;C 元素原子的电子层结构中,最外层电子数是次外层电子数的3 倍。根据上述条件回答:
(l)写出下列元素的元素符号:A _____________________、C_____________________ ;
(2 ) A、C、B 三元素形成的化合物与B、D 两元素形成的化合物在水溶液中反应的离子方程式为_______________________________________________________ ;
(3)写出铁在D2中燃烧的化学方程式。
________________________________________________________________.
33.某有机物A ,由碳、氢、氧三种元素组成,在一定条件下,由A~E 的转化关系如下图所示。已知B 为烯烃,其气体密度是相同条件下氢气的14 倍。
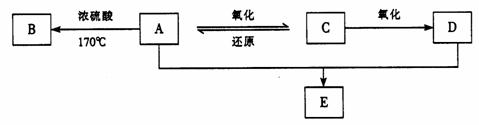
(1)写出下列物质的结构简式:B_______________ , C_________________。
(2)请你列举出B 物质在化学工业上的一种用途:_______________________________。
(3)写出实现下列转化的化学方程式:
A D  E H2O:_________________________________________________。 E H2O:_________________________________________________。
三、简答题(本题包括3 个小题,每空1 分,共12 分)
34.用一种试剂可以将K2SO4 溶液、BaCl2溶液、K2CO3 溶液三种无色透明溶液鉴别出来,此试剂是____________________________________。用一种试剂可以将NaCl 溶液、KBr 溶液、KI 溶液三种无色透明溶液鉴别出来,此试剂是__________________________。
35.实验室中分离难溶于水的MnO2和KCl组成的混合物的方法和步骤如下:
(l)先将混合物在烧杯中加人适量水溶解。为加快溶解速度,常采用的方法有_____________、_________________等。
(2)将所得液体进行__________________________,该操作所用玻璃仪器有________、__________、___________等。
(3)洗涤、干燥沉淀得到MnO2。将第(2)步操作所得液体进行蒸发、结晶得到KCl。
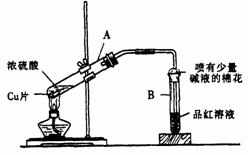
36.下图是进行铜与浓硫酸反应并进行产物检验的装置。
(l ) A 试管内发生反应的化学方程式是_____________________________________。
(2)反应后A 试管中的液体用适量水稀释后显______________________色;B 试管中品红溶液的颜色最后变为_________________。
(3 ) B 管口喷有碱液的棉花的作用是____________________________________________。
四、计算题(本题包括2 个小题,共10 分)
37.( 4 分)将标准状况下的HCl 气体多少L 溶于适量水可以配得100 mL , 0.2 mol/L 的盐酸?
38.( 6 分)取100 mL Na2CO3 和Na2SO4的混合溶液,加过量BaCl2溶液后得到16.84g 白色沉淀,沉淀用过量稀HNO3 处理质量减少到6.99g ,并有气体放出。试计算:
(1)原混合溶液中Na2SO4 的物质的量浓度;
(2)产生的气体在标准状况下的体积。
普通高中毕业会考化学试题
化 学参考答案
第I卷
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
答案 |
A |
B |
A |
B |
D |
C |
D |
D |
D |
B |
A |
A |
C |
|
题号 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
|
答案 |
B |
D |
C |
A |
C |
C |
C |
B |
A |
B |
C |
C |
|
第II卷
二、
26、(1)C (2)A (3)E (4)B (5)D
27、1:1 2:3 1:1
28、正反应方向 逆反应方向 正反应方向
29、(1)③ (2)② (3)①
30、增大 减小 减小
31、CH3CH2CH2CH3 CH3CH(CH3)2 异丁烷(或2-甲基丙烷)
32、(1)Na O
(2)H OH-=H2O
(3)2Fe 3Cl2 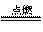 2FeCl3 2FeCl3
33、(1)CH2=CH2 CH3CHO
(2)制聚乙烯塑料或制工业酒精等
(3)CH3COOH C2H5OH  CH3COOC2H5 H2O CH3COOC2H5 H2O
三、
34、稀硫酸 AgNO3 溶液
35、(1)搅拌、振荡
(2)过滤 漏斗、玻棒、烧杯
36、(1)Cu 2H2SO4(浓)  CuSO4 SO2 ↑ 2H2O CuSO4 SO2 ↑ 2H2O
(2)蓝 无色
(3)吸收多余的SO2 ,防止空气污染
四、
37、解:V(HCl)=0.100L×0.2mol/L×22.4L/mol=0.448L
38、解:有关化学方程式
①BaCl2 Na2SO4 =BaSO4↓ 2NaCl
②BaCl2 Na2CO3 =BaCO3↓ 2NaCl
③BaCO3 2HNO3 =Ba(NO3)2 CO2↑ H2O
(1)n(Na2SO4)=n(BaSO4)= EQ \f(6.99g,233g/mol)=0.03mol
所以c(Na2SO4)= EQ \f(0.03mol,0.1L)0.3mol/L
(2)n(CO2 )=n(BaCO3)= EQ \f(16.84g-6.99g,197g/mol)=0.05mol
所以V(CO2 )=0.05mol×22.4L/mol=1.12L
|