|
专题练习二 物质结构与性质
1.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是 ( )
A.是氢的一种新的同素异形体 B.是氢的一种新的同位素
C.它的组成可用H3表示 D.它比一个普通H2分子多一个氢原子核
2.下列物质性质的变化规律与分子间作用力有关的是 ( )
A.HF、HCl、HBr、HI的热稳定性依次减弱 B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低 D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
3.共价键、离子键和范德瓦尔斯力都是微粒之间的不同作用力,下列含有上述两种结合力的是 ( )
①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷
A.①②④ B.①③⑥ C.②④⑥ D.③④⑤
4.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是 ( )
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
5.下列说法中不正确的是 ( )
①质子数相同的粒子一定属于同种元素;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数:⑥某种元素的相对原子质量取整数,就是其质量数。
A.①②④⑤ B.③④⑤⑥ C.②③⑤⑥ D.①②⑤⑥
6.据报导用激光将置于铁室中的石墨靶上的碳原子“炸松”,与此同时再用一个射频电火花喷射出氮气,此时碳、氮原子结合成碳氮化合物的薄膜,该膜的硬度可比金刚石更坚硬,其原因可能是 ( )
A.碳、氮原子构成网状的原子晶体 B.膜中的C--N键长比金刚石的C—C键长短
C.碳、氮都是非金属,化合时放出大量热 D.相邻主族非金属的化合物比单质硬度大
7.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a—b),L层电子数是(a b),则A、B两种元素形成的化合物的化学式可能表示为 ( )
A.B3A2 B.BA2 C.A3B2 D.AB2
8.某主族元素的离子X2 有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄色气体产生,则下列说法不正确的是 ( )
A.X2 具有还原性 B.X的 2价化合物比 4价化合物稳定
C.XO2具有强氧化性 D.该元素是第ⅡA族元素
9.推断下列化合物的化学式:
⑴X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是_____;若XY2是共价化合物其化学式是______。
⑵第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为______。
⑶1mol某物质含有不同周期三种元素的原子各1mol,其质子总数为20mol,该物质的化学式为______。
⑷某非金属X的最高正价为 m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是________。
⑸X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是_________ 。
10.A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是______________________,C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是______________________________________________________。
⑷C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________。
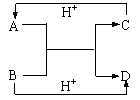 11.A、B、C、D是中学化学中常见的含有相同电子数的离子或分子。其中A是由5个原子构成的粒子。它们之间的相互反应关系如下图。 11.A、B、C、D是中学化学中常见的含有相同电子数的离子或分子。其中A是由5个原子构成的粒子。它们之间的相互反应关系如下图。
⑴写出A、B的电子式。A B 。
⑵C与D相似,在液态时C也可以发生微弱的电离,电离出含有相同电子数的两种微粒,则C的电离方程式为____________________________________。
⑶金属钠能与液态C反应:Na+C→X H2,写出在液态C中X跟NH4Cl反应的化学方程式 。
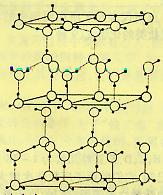 12.水分子间存在一种叫“氢键”的作用(介于范德瓦尔斯力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体一次,其结构示意图如图所示 12.水分子间存在一种叫“氢键”的作用(介于范德瓦尔斯力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体一次,其结构示意图如图所示
⑴1mol冰中有 mol“氢键”
⑵水分子可电离生成两种含有相同电子数的微粒,其电离方程式为: 。
⑶在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德瓦尔斯力(11kJ•mol—1)。已知冰的升华热是51 kJ•mol—1,则冰晶体中氢键的能量是 kJ•mol—1
⑷用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是 ,其判定依据是_________________________________
__________________________________________________________________________。
13.已知FexO晶体晶胞结构为NaCl型(其晶胞的一个面如图),由于晶体缺陷,x值小于1。测知FexO晶体密度ρ为5.71g·cm-3,晶胞边长为4.28×10-10m。求
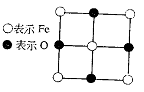 ⑴FexO中x值(精确至0.01)为多少? ⑴FexO中x值(精确至0.01)为多少?
(2)晶体中的Fe分别为Fe2 、Fe3 ,在Fe2 和Fe3 的总数中Fe2 所占分数(用小数表示,精确到0.001)为多少?
(3)在完整晶体中,与O2-等距且最近的6个Fe占据空隙是何种几何外形?
(4)在晶体中,铁元素的离子间最短距离为多少米?
《专题练习二 物质结构与性质》参考答案
1.D 2.D 3.B 4.A 5.D 6.AB 7.B 8.D
9.⑴CaF2 CS2 (2)MgS (3)NaOH 或 LiHS
(4)H2b-mXOb (5)KCl 或CaCl2
10.⑴  第二周期、第ⅦA族 ⑵ Na 第二周期、第ⅦA族 ⑵ Na
⑶ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ⑷ Na3AlF6
 11.(1)略 (2)2NH3 NH4 NH2- (3)NaNH2 NH4Cl = NaCl 2NH3 11.(1)略 (2)2NH3 NH4 NH2- (3)NaNH2 NH4Cl = NaCl 2NH3
 12.(1) 2 (2) H2O H2O H3O OH- 12.(1) 2 (2) H2O H2O H3O OH-
(3) 20 (4) x > z > y 水中含氢键,故沸点最高,硒化氢比硫化氢相对分子质量大,分子间作用力大,故硒化氢沸点高。
13.(1) 根据NaCl的晶体结构分析,若取1mol该晶胞,则有4molFexO.
即:(4.28×10-8cm)3×6.02×1023mol-1×5.71g·cm-3=4(56x 16)g·mol-1
x=0.92
(2) 设0.92个Fe原子中Fe2 有n个
由电荷守恒:2n 3(0.92-n)=1×2
n=0.76
则Fe2 所占的分数: 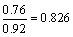 。 。
(3)由晶体的立体结构分析,与O2-等距且最近Fe占据空隙为八面体结构。
(4) 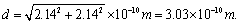
|