| |
|
[组图]高中化学第三学期半期试题
|
| 查询化高二上末的详细结果
|
|
相对原子质量H-1,N-14,O-16,C-12,Cu-64
第I卷选择题(答案请写在第3页的表格中)
每小题只有一个选项符合题意,共48分
1.下列关于氮族元素的说法中不正确的是 ( )
A、原子的最外层均有5个电子,最高价均为 5价
B、非金属性比同周期的氧族元素和卤族元素弱
C、原子半径比同周期的氧族元素、卤族元素小
D、稳定性:NH3 >PH3
2.下列说法中不正确的是( )
A、NO中有少量的NO2:用水洗涤后再干燥
B、白磷应保存在水中,切割白磷应在水下进行。
C、N2中有少量的O2:通过灼热的铜网
D、红磷中有少量的白磷:加热到40℃,使白磷自燃
3.取三张蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加65%的HNO3、
98.3%的H2SO和新制的氯水,三张试纸最后依次呈现的颜色是( )
A.白、红、白 B.红、黑、红 C.红、红、红 D.白、黑、白
4.将1molCO和1mol NO2充入反应器中有反应CO(g NO2(g)  CO2(g) NO (g)达平衡时CO的转化率为50%,在其它条件不变时,若将1molCO和2mol NO2充入该容器中达平衡时,混合气体中CO2的体积分数可能为( ) CO2(g) NO (g)达平衡时CO的转化率为50%,在其它条件不变时,若将1molCO和2mol NO2充入该容器中达平衡时,混合气体中CO2的体积分数可能为( )
A.1/9 B.1/6 C.2/9 D.1/3
5.下列反应中,能说明NH3 既有碱性又有还原性的是( )
A 2 NH3 2Na==2NaNH2 H2 B 8 NH3 3Cl2==6NH4Cl N2
C 2 NH3 3CuO==N2 3Cu 3H2O D 4 NH3 6NO==5N2 6H2O
6.下列分子中,属于极性键组成的非极性分子是:( )
A.CO2 B.NH3 C.N2 D.HCl
7、下列离子方程式不正确的是 ( )
A、(NH4)2CO3溶液与足量的NaOH溶液混合加热:NH4 OH- ==NH3↑ H2O
B、Cl2通入到FeCl2溶液中:Cl2 Fe2 == 2Cl- Fe3
C、将银片投入到浓硝酸溶液中:Ag 2H NO3 - == Ag NO2↑ H2O
D、过量Ba(OH)2和磷酸溶液反应:3Ba2 6OH- 2H3PO4==Ba3(PO4)2↓ 6H2O
8、6.4g铜放入400ml浓度为0.5mol/L的硝酸中,充分反应后,被还原的HNO3的量为 ( ) A、0.03mo l B、0.05mol C、0.1mol D、0.2mol
9.可逆反应N2(g) 3H2(g)  2NH3(g)的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( ) 2NH3(g)的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
A.3ν正(N2)= ν正(H2) B.ν正(N2)= ν正(NH3)
C.2ν正(H2)=3 ν逆(NH3) D.ν正(N2)=3ν 逆(H2)
10.已经建立化学平衡的某可逆反应,当改变条件使平衡向正反应方向移动时,下列有关叙述中正确的是( )
A.生成物的质量分数一定增加 B.生成物的物质的量一定增加
C.反应物的转化率一定增加 D.反应物的浓度一定降低
11.反应A(g)+2B(g)  2C(g)+2D(s)(放热反应)达到平衡后,假如要使v(正)增大,化学平衡向正反应方向移动,而A的转化率降低,可采取的措施 2C(g)+2D(s)(放热反应)达到平衡后,假如要使v(正)增大,化学平衡向正反应方向移动,而A的转化率降低,可采取的措施
A.升高温度 B.多加催化剂 C.缩小容器体积 D.增大A的浓度
12.对于反应2A(g) xB(g)  4C(g)达到平衡时,C的浓度为1.2mol/L,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol/L,则x的值为( ) 4C(g)达到平衡时,C的浓度为1.2mol/L,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol/L,则x的值为( )
A.1 B.2 C.3 D.4
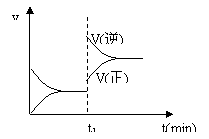 13.下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是( ) 13.下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
A.2SO2(g) O2(g)  2SO3(g)(放热反应) 2SO3(g)(放热反应)
B.4NH3(g) 5O2(g)  4NO(g) 6H2O(g)(放热反应) 4NO(g) 6H2O(g)(放热反应)
C.H2(g) I2(g)  2HI(g)(吸热反应) 2HI(g)(吸热反应)
D.C(s) H2O(g)  CO(g) H2(g)(吸热反应) CO(g) H2(g)(吸热反应)
14.在密闭容器中充入A、B两种气体,在一定条件下反应:
2A(g) B(g)  2C(g) ; ΔH<O.达到平衡后,改变一个条件,下列量(Y)的变化一定符合图中曲线的是( ) 2C(g) ; ΔH<O.达到平衡后,改变一个条件,下列量(Y)的变化一定符合图中曲线的是( )
|
|
X |
Y |
|
A |
再加入A |
A的转化率 |
|
B |
再加入C |
A的体积分数 |
|
C |
减小压强 |
A的转化率 |
|
D |
降低温度 |
混合气体平均摩尔质量 | |
| |

15.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A 3B  2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( ) 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
①原混和气体的体积为1.2V升 ②原混和气体的体积为1.1V升;
③达平衡时气体A消耗掉0.05V升; ④达平衡时气体B消耗掉0.05V升;
A.②③ B.②④ C.①③ D.①④
16.在一个固定体积的密闭容器中,2molA和1molB发生反应2A(g) B (g)  3C(g) D(g),达到平衡时,C的浓度为W mol/L。维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol/L,该配比是( ) 3C(g) D(g),达到平衡时,C的浓度为W mol/L。维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol/L,该配比是( )
A.3molC 1molB B.1molA 0.5molB 1.5molC 0.5molD C.4molA 2molB D.3molC 1molD 2molA 1molB
选择题答案(共48分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
第II卷(共52分)
17.(9分)
I.可逆反应A(g) 2B(g)  2C(g)(放热反应);在一定条件下达到平衡, 2C(g)(放热反应);在一定条件下达到平衡,
改
 变条件,将变化结果(填“增大”、“减小”或“不变”),填入空格。 变条件,将变化结果(填“增大”、“减小”或“不变”),填入空格。
(1)升高温度,B转化率 ,  。 。
(2)保持温度和压强不变,加入稀有气体,则C的物质的量 。
(3)保持温度和体积不变,再加入稀有气体,A的转化率 。
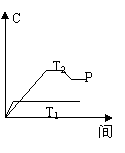
II..在一定条件下,可逆反应A B  mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问: mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
⑴温度T1 T2(填“大于”、“等于”或“小于”)
⑵正反应是 反应(填“吸热”或“放热”)
⑶假如A、B、C均为气体,则m 2(填“大于”、“等于”或“小于”)
 ⑷当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体.则体系的压强 (填“增大、“减小”或“不变”),平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)。 ⑷当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体.则体系的压强 (填“增大、“减小”或“不变”),平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
18.(11分)右图是某化学爱好小组同学设计的研究铜和稀硝酸反应速率[υ(NO)]的实验装置图。试回答下列问题:⑴写出铜和稀硝酸反应的化学方程式_____________________________ 。
⑵为测定铜和稀硝酸反应速率[υ(NO)],本实验需要记录的实验数据为:________ 、________
⑶实验前怎样检验装置的气密性 __________________________________
⑷为保证实验的成功,加入一定量稀硝酸是很重要的操作,你认为应怎样操作?
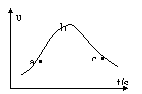 ____________________________,后将弯曲的铜丝迅速伸入溶液并开始____________________________。 ____________________________,后将弯曲的铜丝迅速伸入溶液并开始____________________________。
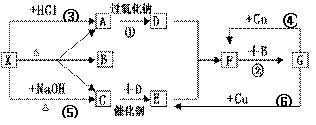
⑸该爱好小组同学对实验数据进行处理后得到用NO表示铜和稀硝酸的反应速率和时间的关系图如下图所示。则:
①a→b.υ(NO)变化的主要原因是________________________ ②b→c.υ(NO)变化的主要原因是_________________________ 。
19. (10分)下图中的每一个方格中的字母表示有关的一种反应物或生成物,其中A、C为无色气体,C能使湿润的红色石蕊试纸变蓝。已知X不与氯化钡反应,请填写下列空白:
⑴化学式:X ,C ,
 F ,G 。 F ,G 。
⑵反应④的离子方程式是:
;
⑶C和D反应的化学方程式:
⑷反应⑤的化学方程式
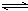 20.(6分)在恒温时,反应2L(g) 3M(g) Q(g) 3R(g),在一个可变的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R。 20.(6分)在恒温时,反应2L(g) 3M(g) Q(g) 3R(g),在一个可变的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R。
请回答:(1)若起始反应从逆反应开始达到相同的平衡状态时,Q的转化率为___________。
(2若起始时反应向逆反应方向进行,则Q的初始物质的量n(Q) 的取值范围是_______
 21.(8分)在恒温时,某容积为V L的密闭容器中通入2 moL X和1 moL Y气体,发生如下反应:2X(g)+Y(g) 21.(8分)在恒温时,某容积为V L的密闭容器中通入2 moL X和1 moL Y气体,发生如下反应:2X(g)+Y(g)  2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。(1)若与上述平衡保持同温、同压,另取4 moL X(气)和2 moL Y(气)达平衡,则Z的体积分数为 ,平衡时,气体的总体积为 ; 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。(1)若与上述平衡保持同温、同压,另取4 moL X(气)和2 moL Y(气)达平衡,则Z的体积分数为 ,平衡时,气体的总体积为 ;
(2)若与上述平衡保持同温,于一密闭容器中充入X(气)和Y(气)的物质的量分别记为a、b,平衡时Z的体积分数也恰好为0.4。若恒有m< 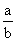 < n,则m = ___,n= 。 < n,则m = ___,n= 。
22.(8分)铜与一定浓度HNO3反应时,方程式可表示为:
Cu HNO3―Cu(NO3)2 NO2 NO H2O(未配平)
(1)该反应中HNO3表现的性质是_____________________, 还原产物是______________
(2)0.3molCu被完全溶解后,失去的电子数是__________(用含NA表示);
若得到NO2和NO的物质的量相同,则参加反应的HNO3物质的量为____________
若用排水法收集这些气体,可得到标准状况下的气体体积为____________
(3若参加反应的Cu,HNO3物质的量之比是5:14,写出并配平该反应的离子方程式
____________________________________________________________________
第三学期化学半期试题答案
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
C |
D |
D |
C |
B |
A |
B |
B |
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
C |
B |
D |
A |
B |
D |
A |
B |
17(9分)I.(1) 减小. 增大 (2) 减小 (3) 不变
II.⑴大于 (2)放热 (3)大于 (4)增大 不
18(11分)⑴3Cu 8HNO3 == 3Cu(NO3)2 2NO↑ 4H2O(2分)
⑵NO的体积、反应时间(各1分)
⑶关闭分液漏斗盖b和活塞a,从U管长管处加水至U管长管中液面高于短管中液面,过一会,若液面差保持不变,则装置气密性良好。(2分)
⑷打开分液漏斗盖b和活塞a,从U管右端注入稀HNO3至排尽U管左端空气,关闭活塞a;(2分) 记录时间;(1分)
⑸①铜和稀硝酸反应是放热反应,体系温度升高,反应速率加快。(1分) ②反应进行一段时间后,体系与环境的温差大,散热加快,体系温度变化不大甚至有所下降,c(HNO3)降低,反应速率降低。(1分)
19(10分)⑴ NH4HCO3 、NH3 、NO2 、HNO3(各1分)
⑵Cu 4H NO3-(浓)===Cu2 2NO2 ↑ 2H2O(2分)
⑶4 NH3 5 O2 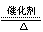 4NO 6H2O;(2分) 4NO 6H2O;(2分)
⑷NH4HCO3 2NaOH  Na2co3 NH3↑ 2H2O↑(2分) Na2co3 NH3↑ 2H2O↑(2分)
20(6分)⑴20% ⑵0.8<n(Q)≤1
21(8分)⑴ 0.4 5/3L ⑵ m= 0.5 n= 5
22(8分)(1)酸性,氧化性;NO2和NO
⑵0.6NA, 0.9mol, 4.48L(无单位为给分)
⑶ 5Cu 14H 4NO3-=5Cu2 NO2↑ 3NO↑ 7H2O(该空3分,其它各1分)
|
 变条件,将变化结果(填“增大”、“减小”或“不变”),填入空格。
变条件,将变化结果(填“增大”、“减小”或“不变”),填入空格。
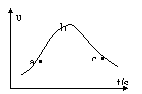 ____________________________,后将弯曲的铜丝迅速伸入溶液并开始____________________________。
____________________________,后将弯曲的铜丝迅速伸入溶液并开始____________________________。
 F ,G 。
F ,G 。