|
化 学
说明:本试卷分为第Ⅰ卷和第Ⅱ卷,考试时间为90分钟,满分为100分。请将第Ⅰ卷试题的正确答案用ⅡB铅笔涂在答题卡上,将第Ⅱ卷试题的正确答案写在第Ⅱ卷对应的位置上,考试结束时只交答题卡和答题卷。
可能用到的原子量:H:1 C:12 N:14 O:16 S:32 Cl:35.5 Na:23 Fe:56
第Ⅰ卷 选择题(共48分)
(本题包括18个小题,每小题3分,每小题只有一个选项符合题意)
1.下列物质中属于有毒的单质是( )
A.一氧化氮 B.红磷 C.白磷 D.偏磷酸
2.常温下最难与浓硝酸发生持续反应的是( )
A.Al B.Mg C.Cu D.Ag
3.下列试剂保存方法正确的是( )
A.浓HNO3放在棕色瓶中 B.白磷放在煤油中
C.氨水放在密闭容器中 D.钠放在冷水中
4.既能用浓H2SO4干燥,又能用碱石灰干燥的气体是( )
A.NO2 B.H2S C.NH3 D.H2
5.下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是( )
A.HCl、CaCO3、SO2 B.HClO、H2S、C2H5OH
C.KNO3、CH3COOH、NH3 D.BaSO4、H3PO4、H2O
6.制取相同质量的Cu(NO3)2时,消耗硝酸的量最多的是( )
A.铜与浓HNO3反应 B.铜与稀硝酸反应
C.氧化铜与硝酸反应 D.氢氧化铜与硝酸反应
 7.反应C(s) H2O(g) CO(g) H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( ) 7.反应C(s) H2O(g) CO(g) H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( )
A.增加CO的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
8.对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为 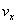 ,(x代表某反应物或生成物)之间的关系,正确的是( ) ,(x代表某反应物或生成物)之间的关系,正确的是( )
A. 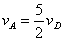 B. B. 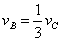 C. C. 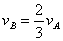 D. D. 
9.相同状况下,4体积NO2与1.5体积O2混合通过足量水,收集到的气体体积为( )
A.0.5体积 B.2体积 C.3体积 D.4.5体积
10.在一个恒温密闭容器中,放入3L气体X和2L气体Y,在一定条件下发生下列反应:
4X(g) 3Y(g)  2Q(g) nR(g)。达到平衡时,容器内压强比原来增加5%, 2Q(g) nR(g)。达到平衡时,容器内压强比原来增加5%,
X的浓度减少 EQ \F(1,3) 。则该反应式中的n应为( )
A.3 B.4 C.5 D.6
11.在一定温度下,N2 3H2  2NH3达到平衡,下列说法使平衡不发生移动的是( ) 2NH3达到平衡,下列说法使平衡不发生移动的是( )
A.恒温恒压时再充入氨气 B.恒温恒容时再充入氮气
C.恒温恒容时再充入氦气 D.恒温恒压时再充入氦气
12.把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应: 3A(g) B(g)  2C(g) x D(g);正向为放热反应,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是( ) 2C(g) x D(g);正向为放热反应,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是( )
A.降低平衡体系的温度,逆反应速率变小,正反应速率增大,平衡正向移动
B.恒温下达到平衡的标志是C和D的生成速率相等
C.A的平均反应速率为0.15mol·(L·min)-1
D.B的转化率为25%
13、Cu2S与一定量的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶3时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A.1∶4 B.2∶5 C.1∶8 D.2∶11
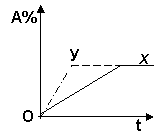 14、右图所示曲线x表示放热反应: 14、右图所示曲线x表示放热反应:
A(g) +B(g)  C(g) +D(g) +E(s) 进行过程中A的转化率 C(g) +D(g) +E(s) 进行过程中A的转化率
随时间变化的关系。若要改变起始条件,使反应过程按y曲线
进行,则下列说法中正确的是( )
A.一定是使用了催化剂
B.可能是加大了E的投入量
C.一定是升高了温度
D.可能是缩小了容器体积
15、用水稀释0.1mol/L氨水时,溶液中随着水量的增加而一定减小的是 ( )
A.c(OH-)/ c(NH3·H2O)
B.c(NH3·H2O)/ c(OH-)
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量
16、向纯水中加入少量NaHSO4(温度不变),则溶液的( )
A.pH升高 B.c (H+)减小 C.c(H )·c(OH-)增大 D.c(H )>c(OH-)
17、关于溶液的酸碱性,下列说法正确的是( )
A.c (H )很小的溶液一定呈碱性
B.pH=7的溶液一定呈中性
C.c(OH-)=c(H )的溶液一定呈中性
D.不能使酚酞试液变红的溶液一定呈酸性
18.下列气体做喷泉实验后所得溶液的物质的量浓度不为1/22.4(mol / L)(假设实验后溶液不扩散)的是 ( )
A. NH3 和空气的混和气体 B.NO2 和NO的混和气体
C. NO2 D.NO和O2的混和气体
|
学 校__________ _____ 班 级____________ 准 考 证 号_________ 姓 名_____________
请 不 要 在 密 封 线 以 内 答 题
……………………密……………………………………………封……………………………………………线……………… |  高中二年级化学上学期期中考试卷 高中二年级化学上学期期中考试卷
化 学
|
题号 |
19 |
20 |
21 |
22 |
23 |
24 |
总分 |
|
得分 |
|
|
|
|
|
|
|
第Ⅱ卷 非选择题(共52分)
(本卷包括6个小题)
19.(4分)某单质与浓硝酸反应,硝酸被还原为NO2,反应中参加反应的单质与HNO3物质的量之比为1∶4,请填空:
(1)假如此单质为某一非金属,则此反应的化学方程式为:
;
(2)若此单质为金属活动顺序表中某一氢后金属,则此反应的化学方程为
。
20.(11分)Ⅰ、恒温、恒压下,在一个可变容积的容器中发生如下反应:
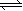 M(g)+ N(g) 3R(g) M(g)+ N(g) 3R(g)
(1) 若开始时放入1 molM和1 molN,到达平衡后,生成a molR,这时M的物质的量为 ____mol;
(2) 若开始时放入2 molM和2 molN,到达平衡后,生成R的物质的量为 mol;
(3) 若开始时放入x molM、2 molN和3 molR,到达平衡后,M和R的物质的量分别是y mol和3a mol,则x= mol,y= mol,平衡时,N的物质的量 (选填一个编号)。
甲、大于1 mol 乙、等于1 mol
丙、小于1 mol 丁、可能大于、等于或小于1 mol
作出此判定的理由是 ;
(4) 若在(3)的平衡混合物中分离出3 mol R,相同条件下待再到达平衡后,R的物质的量分数是 。
Ⅱ、若维持温度不变,在一个与(Ⅰ)反应前起始体积相同、且容积固定的容器中发生上述反应,
(5) 开始时放入1 molM和1 molN到达平衡后生成b molR。将b与(1)小题中的a进行比较 _ _ (选填一个编号)
甲、b<a 乙、b>a 丙、b=a 丁、不能比较a和b的大小
作出此判定的理由是 。
21.(本题12 分)下图中的每一方格表示有关的一种反应物或生成物,其中A和C 为无色气体。
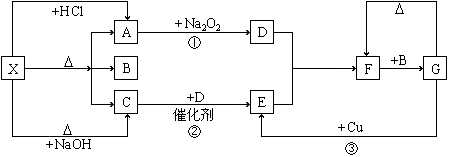
填写下列空白:
(1)物质X的化学式可以是 或 。
(2)C的分子式为 ,空间构型为 ,其分子是由 键形成的 分子,表示C的水溶液呈酸性或碱性的方程式为 。
(3)反应②的化学方程式为: ;
(4)G生成F的化学方程式为 。
22.(本题5分)实验室制取氨气的化学反应方程式是 。可用__________干燥制取的氨。用_____ _____法收集NH3,用 检验NH3是否布满。
23.(本题9分)右图所示装置在实验室中有多种用途,可用做气体的收集、
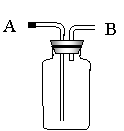 干燥和洗涤(图中烧瓶的位置不得变动),对于下列气体: 干燥和洗涤(图中烧瓶的位置不得变动),对于下列气体:
①H2 ②NH3 ③NO ④NO2 ⑤Cl2 ⑥SO2
(1)若装置是干燥的,则可由B口进气收集的气
体有 (填写序号,下同);
(2)若装置是干燥的,则可由A口进气收集的气体有 ;
(3)若装置布满水,通常可以收集的气体有 ,这时气体由 口进入;
(4)若装置内充入浓硫酸,可用于干燥气体,则可此装置来干燥的气体有 ,这时气体由 口进入;
(5)若要度量生成少量气体的体积,可将烧瓶中盛满水,气体应由___ __口进,还应在___ ___口处连一弯管,并伸入_____ __中(写仪器名);
24、(4分) 将1mol的NO2气体密封于固定容积的容器中,一定温度下发生如下反应:
 2NO2(g) 2NO(g)+ O2(g) 2NO2(g) 2NO(g)+ O2(g)
达到平衡时测得容器中的压强变为起始时的1.2倍。
求:① 平衡时混和气体的相对平均分子质量;
② NO2气体的平衡分解率。
25、(6分)30.0 g Fe2O3和FeS的混和物用足量的稀硫酸溶解并发生反应: Fe2O3+FeS+3H2SO4 = 3FeSO4+S↓+3H2O
充分反应后生成了3.2 g S。
求:混和物中Fe2O3的质量。
化学参考答案
|
题 号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
答 案 |
C |
A |
A |
D |
C |
A |
C |
D |
A |
|
题 号 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答 案 |
A |
C |
C |
C |
D |
B |
D |
C |
D |
19(4分)(1) C+4HNO3( 浓)= CO2↑+4NO4 ↑+2H2O ;
(2) Cu+4HNO3( 浓)= Cu2(NO3)2↑+2NO4 ↑+2H2O 。
20.(11分) (1) 1-a/3 _ (2) 2a
(3) 2 3—a 丁
若a=2,则n(B)=1; a>2,则 n(B)< 1 a<2,则 n(B)> 1 ;
(4) 3a / (6 a)
(5) 甲 因为(5)为恒容,而(1)为 而(1)为恒压,而此反应为气体体积减小的反应,减小压强平衡向逆向移动,(5)中反应开始压强即小于(1),故达平衡时b<a 。
21.(本题12 分) (1) NH4HCO4 或 (NH4)2CO4 。
(2) NH2 三角锥型 极性共价键 极性分子
  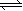 NH2+H2O NH2·H2O NH2·H2O NH4 +OH- NH2+H2O NH2·H2O NH2·H2O NH4 +OH-
(3) 4NH2+5O2 4 NO+ 6H2O

 (4) 4HNO3 4NO2+ O2 +2H2O 。 (4) 4HNO3 4NO2+ O2 +2H2O 。
22.(本题5分) 2NH4Cl+Ca(OH)2 CaCl2 +2NH3 ↑+2H2O 碱石灰 向下排气
用湿润的红色石蕊试纸
23.(本题9分)
(1) ① ② (2) ④ ⑤ ⑥ (3)① ③ B
(4)① ③ ④ ⑤ ⑥ A (5) B A 量茼
24、(4分) ① 38.3 (2分)
② 40% (2分)
25、(6分) 当 Fe2O3不足时,其质量为 16.0 g (3分)
当 Fe2O3过量时,其质量为 21.2 g (3分)
|