班姓名
1.( )某物质在氧气中完全燃烧后,生成物只有二氧化碳和水,以下说法正确的是
A 该物质只含有碳元素和氢元素; B 该物质只含有碳元素和氧元素
C 该物质一定含有碳元素、氧元素、氢元素
D 该物质一定含有碳元素和氢元素,可能含有氧元素
2.( )下列关于有机物的叙述正确的是
A 有机物都是非电解质 B 熔点低的化合物都是有机物
C 不含氢的化合物也可能是有机物 D 含有碳元素的化合物都是有机物
3.( )已知天然气的主要成份CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述:①天然气与煤、柴油相比是较清洁的能源;②等质量的CH4和CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一。其中正确的:A 是①、②、③ B 只有① C 是①和② 只有③
4.( )验证某有机物属于烃,应完成的实验内容属是
A 只测定它的C、H比; B 只要证实它完全燃烧后产物只有H2O和CO2
C 只测定其燃烧产物中H2O与CO2的物质的量的比值
D 测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量
5.( )1mol甲烷完全与氯气发生取代反应,若生成相同物质的量的四种有机取代物,则消耗氯气的物质的量为: A 1mol B 2mol C 2.5mol D 4mol
6.( )瓦斯爆炸是空气中含甲烷5%~15%碰到火源所产生的爆炸。发生爆炸最强烈时,甲烷在空气中所占的体积应是: A 15% B 10.5% C 9.5% D 5%
7.( )完全燃烧某有机物,生成Ag二氧化碳和Bg水,则有机物中碳、氢原子个数之比是: A A︰ B B A/12︰B/2 C A/44︰B/9 D A/44︰B/18
8.( )一定量的甲烷燃烧之后得到的产物为CO、CO2和水蒸气,此混合气体重49.6g,当其缓缓通过足量无水氯化钙时,CaCl2固体增重25.2g,原混合气体中CO2的质量为
 A 12.5g B 13.2g C 19.7g D 24.4g
A 12.5g B 13.2g C 19.7g D 24.4g
9.( )如图所示,一端封闭的U型管,封闭着的一端有一段CH4和Cl2的混合气体,在水平部分有一段气往,其他两段为液体,已知液体与气体不反应,使CH4和Cl2在稍暗的光线下缓慢反应,则中间气柱的长度如何变化(假设中间气柱未移出U型管的水平部分)
A 变大 B 变小 C 不变 D 难以确定
10.体积为V的O2和CH4混和后在150℃时恰好反应,生成CO2、CO和H2O,反应后体积增加了10mL,将上述体积为V的O2和CH4的混和气与装有足量的Na2O2的密闭容器中加热至150℃,充分反应后,气体体积减少了60mL,求原混和气体中CH4和O2各多少mL(反应前后压强与温度不变)
11.在120℃,101kPa条件下,由H2、CH4、CO组成的混合气体amL,通入一定量(设为xrnL)氧气使其完全燃烧。
(1)若amL混合气体完全燃烧消耗相同条件下氧气的体积也为amL即x=a),则原混合气体中CH4的体积分数是 。
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2arnL,则原混合气体中CO2的体积分数是 ,现要测定原混合气体中H2的体积分数,还必须知道相同条件下其他数据可以是 (填选项字母)。
A.2amL混合气体的密度
B.生成CO2气体的总体积
C.生成H2O(g)的总质量
(3)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),则X的取值范围是 。
12.( )由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷36℃,可以判定丙烷的沸点可能是: A高于-0.5℃ B约是+30℃ C约是-40℃ D低于-89℃
13.( )(CH3CH2)2CHCH3的正确命名是
A 3-甲基戊烷 B 2-甲基戊烷 C 2-乙基丁烷 D 3-乙基丁烷
14.( )2,2,6,6-四甲基庚烷的一氯取代物的同分异构体共有
A 2种 B 3种 C 4种 D 5种
15.( )乙烷在光照的条件下与氯气混和,最多可以生成几种物质
A 6种 B 7种 C 9种 D 10种
16.( )进行一氯取代后,只能生成三种沸点不同的有机产物的烷烃是
A (CH3)2CHCH2CH2CH3 B (CH3CH2)2CHCH3
C (CH3)2CHCH(CH3)2 D (CH3)3CCH2CH3
17.( )化学工作者从有机反应RH+Cl2(气) ![]() RCl(液)+HCl(气)受到启发,提出在农药和有机合成工业中可以获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是
RCl(液)+HCl(气)受到启发,提出在农药和有机合成工业中可以获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是
A 蒸馏法 B 水洗分液法 C 升华法 D 有机溶剂萃取法
18.( )分子式为C6H14的链烃中,主链有四个碳原子的同分异构体有
A 1种 B 2种 C 3种 D 4种
19.( )烷烃分子可以看作由以下基团组合而成:-CH3 -CH2- ![]()
![]()
如某烷烃分子中同时存在这四种基团,则该烷烃最少含有的碳原子数应是
A 6 B 7 C 8 D 10
20.( )下列有机物,其一氯代物的结构可能只有一种的是
A C2H6 B C3H8 C C4H10 D C5H12
21.( )在烷烃同系物中,含碳元素质量百分率最大应接近于
A 75% B 80% C 85.7% D 92.3%
22.( )在标准状况下,某气态有机物4L,其质量为12.5g,则该有机物的最简式可能是: A CH B CH2 C CH3 D CH2O
23.( )等质量的下列烃完全燃烧,生成CO2和H2O,耗氧量最多的是
A C2H6 B C3H8 C C4H10 D C5H12
24.( )完全燃烧某有机物,生成Ag二氧化碳和Bg水,则有机物中碳、氢原子个数之比是: A A︰ B B A/12︰B/2 C A/44︰B/9 D A/44︰B/18
25.( )同温同压下,完全燃烧5L相同物质的量的甲烷和丙烷的混和气体与完全燃烧5L相同质量的乙烯和丙烯混和气体,所生成的二氧化碳的质量之比为
A 4︰5 B 5︰3 C 5︰6 D 6︰5
26.( )常温常压下,某气态烃和氧气的混和气体nL,完全燃烧后,通过浓硫酸后再恢复到原来的温度和压强时,得到n/2L的混和气体。假设烃在燃烧后无剩余,且其碳元素全部转化为CO2,则该烃可能是: A C2H4 B CH4 C C3H8 D C2H6
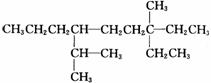
27.给下列直链烷烃用系统命名法命名。
(1) 
(2) ![]()
(3) 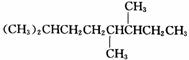
(4) 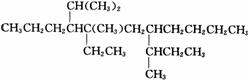
28.烃A的分子量是72,每个A分子中有42个电子,A的一溴代物种数是它的同分异构体中最多的,A的名称是 。
29溴代物的同分异构体有 种。
30.烃A的碳元素的质量分数为75%;烃B充分燃烧后生成6.75g水和8.4L二氧化碳(标准状况);烃C中碳的质量是氢的质量的4倍;13g烃D完全燃烧后生成9g水,写出这四种烃的最简式A 、B 、C 、D 。
31.燃烧0.5mol有机物A生成22g二氧化碳和18g水,同时消耗32g氧气,实验室制取A的化学方程式是 。燃烧0.5mol有机物B生成二氧化碳、水的质量与A相同,但消耗氧气是24g,则B的分子式是 ,结构简式是 。
32.有A、B、C、D、E五种气体,C对空气的相对密度为2.45,在相同温度和压力下,B、D、E的密度之比为4︰2︰1,这五种气体均为常见气体,各气体两两混合时出现如下情况:
气体
A+B
A+E
C+E
D+E
B+C
反应情况
不用光照能反应
不反应
漫射光下反应
点燃反应
有水存在时易反应
据此可以推知:(填化学式)
A ,B ,C ,D ,E 。
33.化学上常用燃烧法确定有机物的组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下图装置是用燃烧法确定有机物分子式常用的装置。
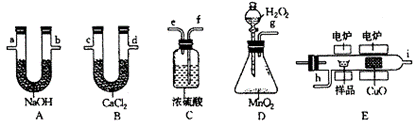
试回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是_____________。
(2)C装置中浓硫酸的作用是____________________________。
(3)D装置中MnO2的作用是 。
(4)燃烧管中CuO的作用是 。
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为 。
(6)要确定该有机物的分子式,还要 。
34.在1.01×105Pa 120℃条件下,将1L丙烷和若干升O2混合点燃,燃烧后,恢复到原来的状态,测得混合气体的体积为m L,将燃烧后的气体再通过碱石灰,气体剩余n L,已知m-n=a,请分析后填写下列空白:
(1)若a=6,则n L气体成分只能是 。
(2)若燃烧前后始终保持1.01×105Pa和120℃,则a的最大值为 ,你确定该最大值的理由是 。
35.已知甲烷与氧气的混和气体,在有足量过氧化钠存在的密闭容器中,点燃充分反应后,总的化学方程式为:2CH4+O2+6Na2O2=2Na2CO3+8NaOH
(1)假设原混和气体中CH4与O2的物质的量分别为xmol、ymol,反应后气体的物质的量为nmol,试确定x与y在不同比值条件下的n值。将结果填入下表:
x︰y
n
2︰1
大于2
小于2
(2)某烃(CxHy)与O2的混和气体在上述条件下反应,若该烃与O2的物质的量之比分别为3︰3和2︰4时,充分反应后剩余的气体的物质的量相同,推断该烃可能的分子式。
爱好题:
36.有一类最简单的有机硅化合物叫硅烷,它的分子组成与烷烃相似。下列说法中错误的是
A 硅烷的分子通式为SinH2n+2 B 甲硅烷燃烧生成二氧化硅和水
C 甲硅烷的密度小于甲烷 D 甲硅烷的热稳定性强于甲烷
37.( )某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个-CH3、两个-CH2-、一个 ![]() 和一个-Cl,它的可能的结构有几种(本题不考虑对映异构体)
和一个-Cl,它的可能的结构有几种(本题不考虑对映异构体)
A 2 B 3 C 4 D 5
38.( )C6H14的同分异构体中所含的甲基数和它的一氯取代物的数目分别是
A 2个-CH3,能生成4种一氯代物
B 3个-CH3,能生成4种一氯代物
C 3个-CH3,能生成5种一氯代物
D 4个-CH3,能生成4种一氯代物
39.( )1,2,3一三苯基环丙烷的3个苯基可以分布在环丙烷环平面的上下,因此有如下两个异构体: ![]() [φ是苯基,环用健表示,C、H原子都未画出〕据此,可判定1,2,3,4,5一五氯环戊烷(假定5个碳原子处于同一平面上)的异构体数目有
[φ是苯基,环用健表示,C、H原子都未画出〕据此,可判定1,2,3,4,5一五氯环戊烷(假定5个碳原子处于同一平面上)的异构体数目有
A 4 B 5 C 6 D 7
40.( )1966年的圣诞节前,在欧拉(1994年度诺贝尔化学奖获得者)的实验室里,一名研究人员将一支快燃尽的蜡烛头扔到一装有化合物SbF5·HSO3F溶液的容器里,结果蜡(烛)很快溶解了;用核磁共振仪研究发现有大量的叔丁基正碳离子(CH3)3C+生成(以前这种离子很难大量得到)。此研究结果表明化合物SbF5·HSO3F具有
A 超强氧化性 B 超强还原性 C 超强酸性 D 超强碱性
41.一个碳原子上假如连有3个氢原子,则这样的氢原子称为伯氢,假如只连有2个氢原子,则这样的氢称为仲氢,例如:-CH3中的氢原子为伯氢,-CH2-中的氢原子为仲氢。已知在烷烃中伯氢和仲氢被取代的活性因反应的条件不同而不同。在高温下伯氢与仲氢被取代的活性相等,则可以称之活性比为1︰1。请回答下列问题:
(1)已知丙烷在高温下与氯气发生取代反应,反应式如下:
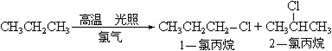
则在一氯代丙烷中1-氯丙烷在产物中的占有率为 ;
(2)常温下丙烷也能与氯气发生取代反应,反应式如下:
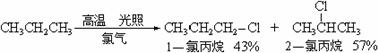
则在常温下伯氢和仲氢的相对活性比为 。
42.某有机化合物M,其分子式为AxByCz,且x+y+z=22。已知M放入水中即水解生成白色沉淀E和无色气体F。白色沉淀E不溶于氨水,能溶于氢氧化钠溶液。取0.1molM放入足量水中,能收集到9g气体F。将该气体在空气中完全燃烧,只生成26.4g二氧化碳和16.2g水,求:
(1)气体F的分子式
(2)有机化合物M的分子式
(3)写出M与过量的氢氧化钠溶液反应的化学方程式。
43.人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤取代物。如:

甲烷 (新)戊烷 十七烷
这一系列具有一定的规律性,当一种烃分子的-H全部被-CH3取代后,它的一卤代物异构体数目不变。试回答:
(1)请写出上一系列第4种烷烃的化学式
(2)请写出上一系列所有烷烃化学式的通式
(3)上一系列烷烃中,其中含碳量最高的烷烃中碳含量的百分率约为
(保留三位有效数字)
(4)人们在研究中发现另一系列烷烃分子也只有一种一卤取代物,请写出它们化学式的通式
44.1994年10月12日,瑞典皇家科学院公布授予美国南加利福尼亚大学有机化学家乔治·安德鲁·欧拉(George·Andrew·Olah)教授1994年度诺贝尔化学奖,以表彰他在碳正离子化学研究方面所作的贡献。
(1)1962年,欧拉和他的同事们把(CH3)3CF溶于过量的SbF5介质中,获得理想的结果,它们之间反应的化学方程式是 ,SbF5属于 类化合物,其理由是 。
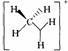
(2)欧拉对碳正离子的贡献不仅在于实验方面,更重要的是他在1972年提出系统的碳正离子新概念。CH3+、CH5+两类碳正离子的结构中,中心碳原子分别采取 、_____杂化方式。试分别画出它们的结构式。
(5)在(C6H5)3C+碳正离子中,除了σ键外,还存在 键,它可表示为 ,形成此种键型的条件是 。
参考答案:
1D
2C
3C
4D
5C
6C
7C
8B
9A
10甲烷的体积为40毫升,氧气为70毫升。
11(1)33.3% (2)50% B (3)0.5a≤x≤2a
12C
13A
14B
15D
16D
17B
18B
19C
20A、D
21C
22B
23A
24C
25C
26B、D
27(1)3一甲基-3-乙基-6-异丙基壬烷 (2)3-甲基-4-乙基已烷 (3)2,5,6-三甲基辛烷 (4)5-甲基-5-乙基-4-异丙基-7-仲丁基十-烷
28 2-甲基丁烷
29 2 4 5
30CH4 CH2 CH3 CH
31CH3COONa+NaOH ![]() CH4↑+Na2CO3 CH4O CH3OH
CH4↑+Na2CO3 CH4O CH3OH
32A:H2S;B:SO2;C:Cl2;D:O2;E:CH4
33(1)g、f、e、h、i、c、d(d、c)、a、b(b、a) (2)吸收水分,得干燥纯净的氧气。 (3)催化剂,加快产生氧气的速率。 (4)使有机物更充分氧化生成二氧化碳和水。 (5)CH2O (6)测出有机物的分子量。
34(1)一氧化碳气体 (2)7L a表示的是碱石灰所吸收的CO2,H2O的总量,而CO2和H2O的最大值只能为7
35(1)0 x-2y y-0.5x (2)C3H4 C3H6 C3H8
36C、D
37C
38C
39A
40C
41(1)75% (2)1︰4
42(1)C2H6 (2)Al(C2H5)3或AlC6H15 (3)Al(C2H5)3+NaOH+H2O=NaAlO2+3CH3CH3↑或Al(C2H5)3+3H2O=Al(OH)3↓+3CH3CH3↑,Al(OH)3+NaOH=NaAlO2+2H2O
43(1)C53H108 (2) ![]() (3)85.7% (4)
(3)85.7% (4) ![]()
44(1)(CH3)3CF+SbF5=(CH3)3C+SbF6- 最强的路易斯酸 SbF5中的中心原子有4d空轨道,能接受其它物质的孤电子对。 (2)sp2 sp3 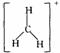
 (3)大π键(离域π键) π
(3)大π键(离域π键) π ![]() ①参与成键的原子必须处于同一平面,即中心原子只能采取sp或sp2杂化类型;②每个参与成键的原子提供一个p轨道,若中心原子采取sp杂化时,有时也可以提供两个p轨道,各产轨道间必须互相平行,以保证这些p轨道最大程度的重叠;③参与成键的p轨道所提供的p电子数目必须小于两倍的p轨道数目。
①参与成键的原子必须处于同一平面,即中心原子只能采取sp或sp2杂化类型;②每个参与成键的原子提供一个p轨道,若中心原子采取sp杂化时,有时也可以提供两个p轨道,各产轨道间必须互相平行,以保证这些p轨道最大程度的重叠;③参与成键的p轨道所提供的p电子数目必须小于两倍的p轨道数目。
