| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
第Ⅱ卷 二、填空(24分) 16.(8分)一无色气体,可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成。将此无色气体通过盛有浓H2SO4的洗气瓶,发现气体体积减少。继续通过装有固体Na2O2的干燥管,发现从出气管出来的气体颜色显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍然为一满试管液体。由此可推知:①原气体中一定含有_____________,一定不会有 ____________;②最终结果可知原气体中_____________气体的体积比为_______。 17.(8分)NO分子对空气会造成污染。近年来发现少量的NO在生物体内许多组织中存在。它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学研究的热点。请回答下列问题: (1)NO对环境危害在于_______________ A 破坏臭氧层 B 高温下使一些金属氧化 C 造成酸雨 D 与人体血液中血红蛋白结合造成缺氧 (2)在含Cu+的酶的活化中心中,亚硝酸离子( NO2-)可转化为NO。写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:___________________________________________。 (3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到500C,发 现气体的压力迅速下降,但压力降至略小于原压力的2/3就不再改变。已知其中一种产物 为N2O,试写出上述变化的化学方程式:________________________________________。 (4)用化学方程式解释(3)中为什么最后的气体总压力小于原压力的2/3?_____________ 18.(8分)(1)m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m : n = 1 : 2.7,该反应 的化学方程式为__________________________________________________________(假设还原 产物只有一种,且只生成一种盐)(3分) (2)含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4 gHNO3被还原成NO(无其它还原产物)则 n 的范围为_________________________(3分) (3)某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是____________ 三、实验题(10分) 19.实验室合成氨装置如图:
试回答: (1)装置甲的作用是:①_______________________,②_____________________________, (2)从丙导出的气体是_______________, (3)乙中发生的反应方程式为________________________________________, (4)检验产物的简单化学方法是__________________________________________________。 四、推断题(8分)
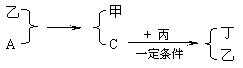 20.A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系: 20.A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
试回答: (1)丙的电子式为___________________ (2)A和乙,单质C和丙所发生反应的化学方程式分别为______________________________, _______________________________________ (3)丙和丁能否在一定条件下反应?_________(填能或不能)。 五、计算题(18分)
(1)A、B和S三种单体中,碳氢比(C:H)值最小的单体是(填符号)______________ (2)经元素分析可知该ABS样品的组成为CaHbNc(a b c 为正整数),则原料中A和B的物质的量之比是_______________(用a b c的代数式表示) 22、(12分)铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物为NH4+,请分析下图,回答有关问题。
(1) 程式 Fe HNO3 = Fe(NO3)3 H2O (2)判定从O点到 a 点时的还原产物为_________________ (3)a 点到 b 点时产物产生的还原产物为________,其原因是________________________ ____________________________________________________ (4)已知达到 d 点时反应完全结束,此时溶液中的主要阳离子为______________________, 分析投入金属铁的物质的量之比 nc (Fe)/nd (Fe) = _______________________。 《氮族元素》测试题答案2004届高考一轮复习检测题(三) 一、选择题答案: 1 B 2 C 3 A 4 C 5 D 6 D 7 C 8 D 9 B 10 B 11 D 12 D 13 A 14 B 15 C *7。As2O3中O为-2价,As为 3价;Na2O2中O为-1价,有氧化性,能将 3氧化为 5价,自身被还原为-2价,故产物为Na3AsO4,As2S3与Na2S2与此类似) 10 用守恒法解。11 由方程式可知,只要能使NO和NO2的体积比为1:1就能完全吸收。 12 根据化合价升降总数相等计算。14、根据离子方程式进行计算。 二、填空题 16 ① NH3、NO、CO2,NO2、HCl、H2 ②NO和CO2,2:3
18 (1) 5Fe 12HNO3 = 5Fe(NO3)3 N2 6H2O (由质量比求出物质的量之比,再根据得失电子总数相等来计算) (2)16.8 ≤ n ≤ 25.2 (分别讨论生成 2、 3价铁的硝酸盐两种情况,利用得失电子数相等) (3)N2O或NH4NO3 (根据化合价升降总数相等来计算) 三、实验题
(2)NH3、N2、H2 (3)N2 3H2 2NH3
(3)能。(6NO 4NH3 = 5N2 6H2O,根据NO、NH3中N的化合价判定,NO2与NH3也能反应,二者都属化合价归中反应) 五、计算题 21 (1)B (A、B、C中C:H值分别是1:1、4:6 = 2:3、1:1) (2)c:(b-a)/2 [(2)方法一:由氮原子守恒可知,平均每个分子中含有c个A分子,设含B、C分子分别为X、Y。根据C、H守恒分别有:3c 4X 8Y = a,3c 6X 8Y = b,解得X =(b-a)/2。 方法二:(由分子式可知,ABS分子中含有c个A分子,由A、B、C的分子式可知,只有B分子中氢原子数比碳原子多2,因此,ABS分子中氢原子数比碳原子数多2个,必含一个B分子)]
(b到c之间,由于反应已进行了一段时间,硝酸的浓度变得很稀,因此还原产物为NH4+,且此时气体的体积不变,所以产物应为NH4NO3 (2)NO (3)N2O,铁与稀硝酸的反应为放热反应,随着反应的进行,溶液的温度逐渐升高。 (4)Fe2+、NH4+,2:3 (在c点时,硝酸已消耗完,以后发生的反应是:2Fe3+ Fe = 3 Fe2+,此时消耗的Fe为a到c之间Fe的一半) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |