|
一、非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1, 氧化性:
F2 H2 === nF2 2M=== (M表示大部分金属)
2F2 2H2O=== Cl2 H2 ===
3Cl2 2P=== Cl2 PCl3 ===
Cl2 2Na=== 3Cl2 2Fe===
Cl2 2FeCl2 === Cl2 Cu===
2Cl2 2NaBr=== Cl2 2NaI ===
Cl2 Na2S=== Cl2 H2S===
Cl2 SO2 2H2O=== 2O2 3Fe===
S H2=== S Fe===
S 2Cu=== N2 3H2===
N2 3Mg== P4 6H2==
2.还原性
S O2===SO2 S 6HNO3(浓)==
3S 4 HNO3(稀)=== N2 O2===
4P 5O2=== C 2Cl2===
2C O2(少量)=== C O2(足量)===
C CO2=== C H2O===
2C SiO2=== Si 2NaOH H2O===
Si(粉) O2===
3.(碱中)歧化
Cl2 H2O=== (加酸抑制歧化,加碱或光照促进歧化)
Cl2 2NaOH===
2Cl2 2Ca(OH)2===
二、金属单质(Na,Mg,Al,Fe)的还原性
2Na H2=== 4Na O2===
2Na2O O2=== 2Na O2===
2Na S=== (爆炸) 2Na 2H2O===
4Na TiCl4(熔融)=== Mg Cl2===MgCl2
2Mg O2=== 2Mg TiCl4(熔融)===
Mg 2H2O=== Mg H2SO4===
2Mg CO2=== 2Al 3Cl2===4Al 3O2=== 4Al 3MnO2===
2Al Cr2O3=== 2Al 3FeO===
2Al Fe2O3=== 2Al 3H2SO4===
2Al 6HCl=== Al 4HNO3(稀)===
2Al 6H2SO4(浓)=== (Al,Fe在冷,浓的H2SO4,HNO3中钝化)
2Al 2NaOH 2H2O=== 2Fe 3Br2===
Fe I2===FeI2 Fe S===
3Fe 4H2O(g)=== Fe 2HCl===
Fe CuCl2=== Fe SnCl4===
(铁在酸性环境下,不能把四氯化锡完全还原为单质锡
三、非金属氢化物(HF,HCl,H2O,H2S,NH3)
1,还原性:
4HCl(浓) MnO2== 4NH3 5O2==
2H2S O2(少量)=== 2H2S SO2===
H2S H2SO4(浓)=== 3H2S 2HNO3(稀)===
2,酸性:
4HF SiO2=== 此反应广泛应用于测定矿样或钢样中SiO2的含量)
H2S CuCl2=== H2S 2AgNO3==
NH3 HCl=== NH3 HNO3===
2NH3 H2SO4==
NH3 NaCl H2O CO2=== (此反应用于工业制备小苏打,苏打)
4,不稳定性:
2H2O=== 2H2O2=== H2S===
四,非金属氧化物
低价态的还原性:
2SO2 O2===
SO2 Cl2 2H2O=== SO2 Br2 2H2O===
SO2 I2 2H2O=== 2NO O2===
2CO O2=== CO CuO===
3CO Fe2O3=== CO H2O===
氧化性:
SO2 2H2S===
NO2 2KI H2O=== 不能用淀粉KI溶液鉴别溴蒸气和NO2)
CO2 2Mg=== (CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2 2H2=== SiO2 2Mg===
3,与水的作用:
SO2 H2O=== SO3 H2O===
3NO2 H2O=== N2O5 H2O===
P2O5 H2O=== CO2 H2O===
P2O5 3H2O=== (P2O5极易吸水,可作气体干燥剂P2O5 3H2SO4(浓)===
4,与碱性物质的作用:
SO2 Ca(OH)2== (不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3 MgO=== SO3 Ca(OH)2===
CO2 2NaOH(过量)=== CO2(过量) NaOH===
CO2 Ca(OH)2(过量)=== 2CO2(过量) Ca(OH)2===
CO2 2NaAlO2 3H2O=== CO2 C6H5ONa H2O===
SiO2 CaO=== SiO2 2NaOH=== (常温下强碱缓慢腐蚀玻璃)
SiO2 Na2CO3=== SiO2 CaCO3===
五,金属氧化物
1,低价态的还原性:
6FeO O2=== FeO 4HNO3===
2,氧化性:
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.
Fe2O3 3H2=== (制还原铁粉) Fe3O4 4H2===
3,与水的作用:
Na2O H2O===
2Na2O2 2H2O=== (此反应分两步:Na2O2 2H2O=== ;
2H2O2=== . H2O2的制备可利用类似的反应 )
MgO H2O=== (缓慢反应)
4,与酸性物质的作用:
Na2O SO3=== Na2O CO2===
Na2O 2HCl=== 2Na2O2 2CO2===
MgO SO3=== MgO H2SO4===
(Al2O3是两性氧化物)
Al2O3 2NaOH=== Al2O3 3H2SO4===
FeO 2HCl=== Fe2O3 6HCl===
Fe3O4 8HCl===
六、含氧酸
1,氧化性:
(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)
2H2SO4(浓) C=== 2H2SO4(浓) S===
H2SO4 Fe(Al) 室温下钝化
6H2SO4(浓) 2Fe=== 2H2SO4(浓) Cu===
H2SO4(浓) 2HBr=== H2SO4(浓) 2HI===
H2SO4(稀) Fe=== 2H2SO3 2H2S===
4HNO3(浓) C=== 6HNO3(浓) S===
5HNO3(浓) P=== 6HNO3 Fe===
4HNO3 Fe===
2,还原性:
H2SO3 X2 H2O=== (X表示Cl2,Br2,I2)
2H2SO3 O2=== 5H2SO3 2KMnO4===
H2SO3 2FeCl3 H2O===
3,酸性:
H2SO4(浓) CaF2=== H2SO4(浓) NaCl===
H2SO4(浓) 2NaCl===Na2SO4 2HCl↑ H2SO4(浓) NaNO3==
2H2SO4(浓) Ca3(PO4)2===
2HNO3 CaCO3===
(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)
4H3PO4 Ca3(PO4)2=== (重钙)
H3PO4(浓) NaBr=== H3PO4(浓) NaI===
4,不稳定性:
2HClO=== 4HNO3===
H2SO3=== H2CO3===
H4SiO4===
七、碱
低价态的还原性:
4Fe(OH)2 O2 2H2O===
与酸性物质的作用:
2NaOH SO2(少量)=== NaOH SO2(足量)===
2NaOH SiO2=== 2NaOH Al2O3===
2NaOH Cl2=== NaOH HCl===
NaOH H2S(足量)=== 2NaOH H2S(少量)==
3NaOH AlCl3=== NaOH Al(OH)3==
NaOH NH4Cl=== Al(OH)3 NH4Cl 不溶解
3,不稳定性:
Mg(OH)2=== 2Al(OH)3===
2Fe(OH)3=== Cu(OH)2===
八,盐
1,氧化性:
2FeCl3 Fe=== 2FeCl3 Cu===
2FeCl3 Zn=== FeCl2 Mg===
2FeCl3 H2S=== 2FeCl3 2KI===
2,还原性:
2FeCl2 Cl2=== 2Na2SO3 O2===
3,与碱性物质的作用:
MgCl2 2NH3.H2O=== AlCl3 3NH3.H2O===
FeCl3 3NH3.H2O===
4,与酸性物质的作用:
Na3PO4 HCl=== Na2HPO4 HCl===
NaH2PO4 HCl===H3PO4 NaCl Na2CO3 HCl===
NaHCO3 HCl===NaCl H2O CO2↑ 3NaAlO2 AlCl3 6H2O===
3Na2CO3 2AlCl3 3H2O===
5,不稳定性:
Na2S2O3 H2SO4=== NH4Cl==
2Cu(NO3)3=== 2KMnO4===
2KClO3=== 2NaHCO3===
Ca(HCO3)2=== CaCO3===
MgCO3==
高 二 有 机 方 程 式
1、CH4 的燃烧
2、CH4高温分解
丁烷的裂解
CH4 Cl2(1:1)
实验室制乙烯
乙烯燃烧
乙烯与溴水
丙烯与氯化氢的加成
乙烯和水
制聚乙烯
制乙炔
乙炔燃烧
乙炔与溴水
乙炔与氯化氢(1:1)
制聚氯乙烯
苯燃烧
烃燃烧的通式
有机物燃烧的通式
苯与溴反应
苯的硝化反应
苯的磺化反应
苯与氢气反应
甲苯的硝化
C16H34的裂化
乙醇与钠反应
酒精燃烧
乙醇的催化氧化
2—丙醇的分子内脱水
2—丙醇的催化氧化
乙醇的成醚反应(分子间脱水)
乙醇的消去反应(分子内)
乙醇与氢溴酸反应:
苯酚在水溶液中的电离:
苯酚与氢氧化钠
苯酚与碳酸钠溶液
苯酚与钠反应
苯酚钠溶液中通CO2
苯酚溶液与溴水
苯酚制三硝基苯酚
过量苯酚与甲醛在盐酸作用下反应:
乙炔水化法制乙醛
乙烯氧化发制取乙醛
乙醛与氧气
乙醛与氢气
实验室制取银氨溶液:
乙醛银镜反应
甲醛与足量的银氨溶液反应
乙醛与新制Cu(OH)2
甲酸与新制Cu(OH)2反应(常温)
甲酸与新制Cu(OH)2反应(加热)
用醋酸除水垢
制乙酸乙酯
制乙二酸乙二酯
制乙二酸二乙酯
制二乙酸乙二酯
2-羟基丙酸的酯化反应
(1) 一分子的成环
(2) 两分子的成六元环
(3) 两分子的成简单酯
(4)多分子的成连酯化
乙酸乙酯的水解
苯甲酸苯甲酯在NaOH水溶液中水解
葡萄糖的银镜反应
葡萄糖与新制 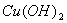 反应 反应
甲酸甲酯与银氨溶液反应:
葡萄糖与氧气
蔗糖的水解
麦芽糖的水解
淀粉的水解
葡萄糖两步制取酒精
纤维素水解
纤维素硝酸酯的制取
纤维素醋酸酯的制取
油酸甘油酯的氢化
硬脂酸甘油酯酸水解
硬脂酸甘油酯碱水解(油脂的皂化反应:)
甘氨酸与NaOH溶液反应;
乙二醇与对苯二甲酸发生缩聚反应
氯乙烷在NaOH溶液中水解成醇:
氯乙烷在NaOH醇溶液中消去成烯:
一、非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1, 氧化性:
F2 H2 === 2HF nF2 2M===2MFn (M表示大部分金属)
2F2 2H2O===4HF O2 Cl2 H2 ===2HCl
3Cl2 2P===2PCl3 Cl2 PCl3 ===PCl5
Cl2 2Na===2NaCl 3Cl2 2Fe===2FeCl3
Cl2 2FeCl2 ===2FeCl3 Cl2 Cu===CuCl2
2Cl2 2NaBr===2NaCl Br2 Cl2 2NaI ===2NaCl I2
Cl2 Na2S===2NaCl S↓ Cl2 H2S===2HCl S↓
Cl2 SO2 2H2O===H2SO4 2HCl 2O2 3Fe===Fe3O4
S H2===H2S S Fe===FeS
S 2Cu===Cu2S N2 3H2===2NH3
N2 3Mg===Mg3N2 P4 6H2===4PH3
2.还原性
S O2===SO2 S 6HNO3(浓)===H2SO4 6NO2↑ 2H2O
3S 4 HNO3(稀)===3SO2↑ 4NO↑ 2H2O N2 O2===2NO
4P 5O2===2P2O5 C 2Cl2===CCl4
2C O2(少量)===2CO C O2(足量)===CO2
C CO2===2CO C H2O===CO H2(生成水煤气)
2C SiO2===Si 2CO↑(制得粗硅) Si 2NaOH H2O===Na2SiO3 2H2↑
Si(粉) O2===SiO2
3.(碱中)歧化
Cl2 H2O===HCl HClO(加酸抑制歧化,加碱或光照促进歧化)
Cl2 2NaOH===NaCl NaClO H2O
2Cl2 2Ca(OH)2===CaCl2 Ca(ClO)2 2H2O
3C SiO2===SiC 2CO↑
二、金属单质(Na,Mg,Al,Fe)的还原性
2Na H2===2NaH 4Na O2===2Na2O
2Na2O O2===2Na2O2 2Na O2===Na2O2
2Na S===Na2S(爆炸) 2Na 2H2O===2NaOH H2↑
4Na TiCl4(熔融)===4NaCl Ti Mg Cl2===MgCl2
2Mg O2===2MgO 2Mg TiCl4(熔融)===Ti 2MgCl2
Mg 2H2O===Mg (OH)2 H2↑ Mg H2SO4===MgSO4 H2↑
2Mg CO2===2MgO C 2Al 3Cl2===2AlCl3
4Al 3O2===2Al2O3(钝化) 4Al 3MnO2===2Al2O3 3Mn
2Al Cr2O3===Al2O3 2Cr 2Al 3FeO===Al2O3 3Fe
2Al Fe2O3===Al2O3 2Fe 2Al 3H2SO4===Al2(SO4)3 3H2↑
2Al 6HCl===2AlCl3 3H2↑ Al 4HNO3(稀)===Al(NO3)3 NO↑ 2H2O
2Al 6H2SO4(浓)===Al2(SO4)3 3SO2↑ 6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)
2Al 2NaOH 2H2O===2NaAlO2 3H2↑ 2Fe 3Br2===2FeBr3
Fe I2===FeI2 Fe S===FeS
3Fe 4H2O(g)===Fe3O4 4H2 Fe 2HCl===FeCl2 H2↑
Fe CuCl2===FeCl2 Cu Fe SnCl4===FeCl2 SnCl2
(铁在酸性环境下,不能把四氯化锡完全还原为单质锡 Fe SnCl2==FeCl2 Sn)
三、非金属氢化物(HF,HCl,H2O,H2S,NH3)
1,还原性:
4HCl(浓) MnO2===MnCl2 Cl2↑ 2H2O 2H2O 2F2===4HF O2
2H2S 3O2(足量)===2SO2 2H2O 4NH3 5O2===4NO 6H2O
2H2S O2(少量)===2S↓ 2H2O 2H2S SO2===3S↓ 2H2O
H2S H2SO4(浓)===S↓ SO2↑ 2H2O 3H2S 2HNO3(稀)===3S↓ 2NO↑ 4H2O
2,酸性:
4HF SiO2===SiF4 2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)
H2S CuCl2===CuS↓ 2HCl H2S 2AgNO3===Ag2S↓ 2HNO3
3,碱性:
NH3 HCl===NH4Cl NH3 HNO3===NH4NO3
2NH3 H2SO4===(NH4)2SO4
NH3 NaCl H2O CO2===NaHCO3 NH4Cl(此反应用于工业制备小苏打,苏打)
4,不稳定性:
2H2O===2H2↑ O2↑ 2H2O2===2H2O O2↑ H2S===H2↑ S↓
四,非金属氧化物
低价态的还原性:
2SO2 O2===2SO3
SO2 Cl2 2H2O===H2SO4 2HCl SO2 Br2 2H2O===H2SO4 2HBr
SO2 I2 2H2O===H2SO4 2HI 2NO O2===2NO2
2CO O2===2CO2 CO CuO===Cu CO2
3CO Fe2O3===2Fe 3CO2 CO H2O===CO2 H2
氧化性:
SO2 2H2S===3S↓ 2H2O
NO2 2KI H2O===NO I2 2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)
CO2 2Mg===2MgO C (CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2 2H2===Si 2H2O SiO2 2Mg===2MgO Si
3,与水的作用:
SO2 H2O===H2SO3 SO3 H2O===H2SO4
3NO2 H2O===2HNO3 NO N2O5 H2O===2HNO3
P2O5 H2O===2HPO3 CO2 H2O===H2CO3
P2O5 3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5 3H2SO4(浓)===2H3PO4 3SO3)
4,与碱性物质的作用:
SO2 Ca(OH)2===CaSO3↓ H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3 MgO===MgSO4 SO3 Ca(OH)2===CaSO4↓ H2O
CO2 2NaOH(过量)===Na2CO3 H2O CO2(过量) NaOH===NaHCO3
CO2 Ca(OH)2(过量)===CaCO3↓ H2O 2CO2(过量) Ca(OH)2===Ca(HCO3)2
CO2 2NaAlO2 3H2O===2Al(OH)3↓ Na2CO3 CO2 C6H5ONa H2O===C6H5OH↓ NaHCO3
SiO2 CaO===CaSiO3 SiO2 2NaOH===Na2SiO3 H2O(常温下强碱缓慢腐蚀玻璃)
SiO2 Na2CO3===Na2SiO3 CO2↑ SiO2 CaCO3===CaSiO3 CO2↑
五,金属氧化物
1,低价态的还原性:
6FeO O2===2Fe3O4 FeO 4HNO3===Fe(NO3)3 NO2↑ 2H2O
2,氧化性:
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.
Fe2O3 3H2===2Fe 3H2O (制还原铁粉) Fe3O4 4H2===3Fe 4H2O
3,与水的作用:
Na2O H2O===2NaOH
2Na2O2 2H2O===4NaOH O2↑(此反应分两步:Na2O2 2H2O===2NaOH H2O2 ;
2H2O2===2H2O O2↑. H2O2的制备可利用类似的反应 )
MgO H2O===Mg(OH)2 (缓慢反应)
4,与酸性物质的作用:
Na2O SO3===Na2SO4 Na2O CO2===Na2CO3
Na2O 2HCl===2NaCl H2O 2Na2O2 2CO2===2Na2CO3 O2↑
MgO SO3===MgSO4 MgO H2SO4===MgSO4 H2O
(Al2O3是两性氧化物)
Al2O3 2NaOH===2NaAlO2 H2O Al2O3 3H2SO4===Al2(SO4)3 3H2O
FeO 2HCl===FeCl2 3H2O Fe2O3 6HCl===2FeCl3 3H2O
Fe3O4 8HCl===FeCl2 2FeCl3 4H2O
六、含氧酸
1,氧化性:
(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)
2H2SO4(浓) C===CO2↑ 2SO2↑ 2H2O 2H2SO4(浓) S===3SO2↑ 2H2O
H2SO4 Fe(Al) 室温下钝化
6H2SO4(浓) 2Fe===Fe2(SO4)3 3SO2↑ 6H2O 2H2SO4(浓) Cu===CuSO4 SO2↑ 2H2O
H2SO4(浓) 2HBr===SO2 Br2 2H2O H2SO4(浓) 2HI===SO2↑ I2 2H2O
H2SO4(稀) Fe===FeSO4 H2↑ 2H2SO3 2H2S===3S↓ 2H2O
4HNO3(浓) C===CO2 4NO2↑ 2H2O 6HNO3(浓) S===H2SO4 6NO2↑ 2H2O
5HNO3(浓) P===H3PO4 5NO2↑ H2O 6HNO3 Fe===Fe(NO3)3 3NO2↑ 3H2O
4HNO3 Fe===Fe(NO3)3 NO↑ 2H2O
2,还原性:
H2SO3 X2 H2O===H2SO4 2HX (X表示Cl2,Br2,I2)
2H2SO3 O2===2H2SO4 5H2SO3 2KMnO4===2MnSO4 K2SO4 2H2SO4 3H2O
H2SO3 2FeCl3 H2O===H2SO4 2FeCl2 2HCl
3,酸性:
H2SO4(浓) CaF2===CaSO4 2HF↑ H2SO4(浓) NaCl===NaHSO4 HCl↑
H2SO4(浓) 2NaCl===Na2SO4 2HCl↑ H2SO4(浓) NaNO3===NaHSO4 HNO3
3H2SO4(浓) Ca3(PO4)2===3CaSO4 2H3PO4
2H2SO4(浓) Ca3(PO4)2===2CaSO4 Ca(H2PO4)2
2HNO3 CaCO3===Ca(NO3)2 H2O CO2↑
(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)
4H3PO4 Ca3(PO4)2===3Ca(H2PO4)2(重钙)
H3PO4(浓) NaBr===NaH2PO4 HBr H3PO4(浓) NaI===NaH2PO4 HI
4,不稳定性:
2HClO===2HCl O2↑ 4HNO3===4NO2↑ O2↑ 2H2O
H2SO3===H2O SO2↑ H2CO3===H2O CO2↑
H4SiO4===H2SiO3 H2O
七、碱
低价态的还原性:
4Fe(OH)2 O2 2H2O===4Fe(OH)3
与酸性物质的作用:
2NaOH SO2(少量)===Na2SO3 H2O NaOH SO2(足量)===NaHSO3
2NaOH SiO2===NaSiO3 H2O 2NaOH Al2O3===2NaAlO2 H2O
2NaOH Cl2===NaCl NaClO H2O NaOH HCl===NaCl H2O
NaOH H2S(足量)===NaHS H2O 2NaOH H2S(少量)===Na2S 2H2O
3NaOH AlCl3===Al(OH)3↓ 3NaCl NaOH Al(OH)3===NaAlO2 2H2O
NaOH NH4Cl===NaCl NH3↑ H2O Al(OH)3 NH4Cl 不溶解
3,不稳定性:
Mg(OH)2===MgO H2O 2Al(OH)3===Al2O3 3H2O
2Fe(OH)3===Fe2O3 3H2O Cu(OH)2===CuO H2O
八,盐
1,氧化性:
2FeCl3 Fe===3FeCl2 2FeCl3 Cu===2FeCl2 CuCl2(用于雕刻铜线路版)
2FeCl3 Zn===2FeCl2 ZnCl2 FeCl2 Mg===Fe MgCl2
2FeCl3 H2S===2FeCl2 2HCl S↓ 2FeCl3 2KI===2FeCl2 2KCl I2
2,还原性:
2FeCl2 Cl2===2FeCl3 2Na2SO3 O2===2Na2SO4
3,与碱性物质的作用:
MgCl2 2NH3.H2O===Mg(OH)2↓ NH4Cl AlCl3 3NH3.H2O===Al(OH)3↓ 3NH4Cl
FeCl3 3NH3.H2O===Fe(OH)3↓ 3NH4Cl
4,与酸性物质的作用:
Na3PO4 HCl===Na2HPO4 NaCl Na2HPO4 HCl===NaH2PO4 NaCl
NaH2PO4 HCl===H3PO4 NaCl Na2CO3 HCl===NaHCO3 NaCl
NaHCO3 HCl===NaCl H2O CO2↑ 3NaAlO2 AlCl3 6H2O===4Al(OH)3↓
3Na2CO3 2AlCl3 3H2O===2Al(OH)3↓ 3CO2 6NaCl
5,不稳定性:
Na2S2O3 H2SO4===Na2SO4 S↓ SO2↑ H2O NH4Cl===NH3↑ HCl↑
NH4HCO3===NH3↑ H2O CO2↑ 2KNO3===2KNO2 O↑2
2Cu(NO3)3===2CuO 4NO2↑ O2↑ 2KMnO4===K2MnO4 MnO2 O2↑
2KClO3===2KCl 3O2↑ 2NaHCO3===Na2CO3 H2O CO2↑
Ca(HCO3)2===CaCO3↓ H2O CO2↑ CaCO3===CaO CO2↑
MgCO3===MgO CO2↑
|