|
高中二年级化学科第一学期期中考试试卷
可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64 Ag:108 C:12 O:16 S:32 Cl:35.5 Br:80
第Ⅰ卷(共78分)
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
1. 实验室制备下列各组气体时,气体的发生装置相同的是 ( )
A. O2和Cl2 B. O2和NH3 C. NH3和Cl2 D. Cl2和H2
2. 反应4NH3+5O2  4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是( ) 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是( )
A.V(O2)=0.01mol·L-1 ·s-1 B.V(NO)=0.008mol L-1 ·s-1
C.V(H2O)=0.015mol L-1 ·s-1 D.V(NH3)=0.002mol L-1 ·s-1
3. 对于反应:N2(g)+3H2(g)===2NH3(g) 热 的平衡体系,在其它条件不变时,采取下列措施,其中能既使正、逆反应速率增大,又能使反应物转化率增大的是
A 增大体系压强 B 升温 C 加入铁触媒 D 减小NH3的浓度
4.对某一可逆反应来说,使用催化剂的作用是( ).
(A) 提高反应物的平衡转化率 (B) 以同样程度改变正逆反应的速度
(C) 增大正反应速度,减小逆反应速度 (D)改变平衡混合物的组成
5. 下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是( )
A. 2NO2 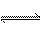 N2O4(正反应为放热反应) B. 3O2 N2O4(正反应为放热反应) B. 3O2  2O3(正反应为吸热反应) 2O3(正反应为吸热反应)
C. H2(g) I2(g)  2HI(g) (正反应为放热反应) 2HI(g) (正反应为放热反应)
D. NH4HCO3(s)  NH3 H2O(g) CO2 (正反应为吸热反应) NH3 H2O(g) CO2 (正反应为吸热反应)
6. 下列溶液中,c (H ) 由小到大的排列顺序正确的是 ( )
① 0.1mol/LHCl溶液 ② 0.1mol/LH2SO4溶液
③ 0.1mol/LNaOH溶液 ④ 0.1mol/LCH3COOH溶液
A. ①③②④ B.③④①② C.④③①② D.③②①④
7. 在一定条件下,发生CO NO2  CO2 NO 的反应, CO2 NO 的反应,
达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法正确的是 ( )
A.正反应为吸热反应 B. 正反应为放热反应
C.降温后CO的浓度增大 D.降温后各物质的浓度不变
8. 可逆反应 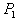 在温度 在温度 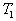 、 、 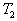 ,压强 ,压强 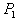 、 、 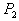 下,产物D的物质的量n与反应时间t的关系如下图,下述各项正确的是( ) 下,产物D的物质的量n与反应时间t的关系如下图,下述各项正确的是( )
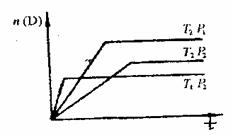 A. A. 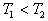
B. 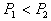
C. 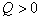
D. 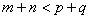
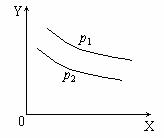 9.反应L(固) aG(气) 9.反应L(固) aG(气)  bR(气)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2 ,X轴表示温度,Y轴表示平衡混合气中G的体积分数。据此可判定: bR(气)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2 ,X轴表示温度,Y轴表示平衡混合气中G的体积分数。据此可判定:
A.上述反应是放热反应
B.上述反应是吸热反应
C.a>b
D.a<b
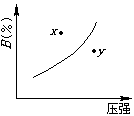 10.mA(s) nB(g) ==== pC(g) Q的可逆反应, 在一定温度下有关 B%与压强P的关系如图,叙述正确的是( ) 10.mA(s) nB(g) ==== pC(g) Q的可逆反应, 在一定温度下有关 B%与压强P的关系如图,叙述正确的是( )
A.m n < p
B.n > p
C.x点时混和物的V正>V逆
D.y点比x点混和物的反应速度快
11. 在一个固定容积的密闭容器中,加入m mol A和n mol B,发生下列反应:mA(g)+nB(g) 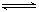 pC(g)。平衡时C的浓度为w mol / L。若维持容积和温度都不变,起始时放入a mol A、b mol B、c mol C,要使平衡后,C的浓度仍为w mol / L,则a、b、c必须满足的关系是 ( ) pC(g)。平衡时C的浓度为w mol / L。若维持容积和温度都不变,起始时放入a mol A、b mol B、c mol C,要使平衡后,C的浓度仍为w mol / L,则a、b、c必须满足的关系是 ( )
A. 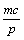 +a=m +a=m 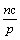 +b = n B. a∶b=m∶n +b = n B. a∶b=m∶n 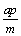 +b=p +b=p
C. a∶b∶c=m∶n∶p D. a= 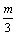 b= b= 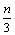 c= c= 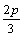
12.已知25%的氨水的密度为0.91g/cm3,5%氨水的密度为0.98g/cm3,若将上述两种溶液等体积混合,所得氨水溶液的质量分数是 ( )
A. 等于15% B. 大于15% C. 小于15% D. 无法估算 13. 在一容积不变的密闭容器充入SO2和O2,从开始到2SO2(g) O2  2SO3(g)达到平衡,始终保持不变的是 ( ) A. 密度 B. 总质量 C. 总压强 D.平均相对分子质量 2SO3(g)达到平衡,始终保持不变的是 ( ) A. 密度 B. 总质量 C. 总压强 D.平均相对分子质量
14. 下列物质的导电性最差的是 ( )
A. 0.1mol/L的盐酸 B. 0. 1mol/L的硫酸
C. 0.1mol/L的醋酸 D. 石墨棒
15.固体NH4I在密闭容器中受热分解发生下列反应:NH4I(s)  HI(g) NH3(g) HI(g) NH3(g)
2HI  H2 I2 (g),达到平衡时,c(HI)=4mol/L, c(I2)=0.5mol/L.下列说法正确的是 ( ) H2 I2 (g),达到平衡时,c(HI)=4mol/L, c(I2)=0.5mol/L.下列说法正确的是 ( )
A.平衡时,c(NH3)=6mol/L B.反应起始时固体NH4I是5mol
C.平衡时HI的分解率为20%
D.若改变反应起始固体NH4I的量,保持其他条件不变,平衡时各气体浓度也发生改变
16.在一个密闭容器中,放入3升X(g)和2升Y(g),在一定条件下发生下列反应:
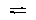 4X(g) 3Y(g) 2Q(g) nR(g) 4X(g) 3Y(g) 2Q(g) nR(g)
达到平衡时,容器内压强比原来增加5% ,X的浓度减小1/3,但温度不变。则该反应方程式中的n值为( )
(A)3 (B)4 (C)5 (D)6
17. 下列事实中,不能用勒沙特列原理来解释的是 ( )
A.加入催化剂有利于氨氧化反应 B. 使氢硫酸中加碱有利于S2-离子增多
C.500℃左右比室温更有利于合成氨反应 D. 高压条件有利于合成氨反应
二、选择题(本题包括6小题,每小题4分,共24分,每小题有一个到两个正确答案)
18.在一定条件下,将1molCO和1molH2O(气)混合后,发生如下反应:
CO(气) H2O(气) 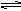 CO2(气) H2(气), CO2(气) H2(气),
反应达到平衡时,测得CO的转化率为21.75%,则平衡时混合气体密度为相同条件下H2密度的 ( )
A.11.5倍 B.15.75倍 C.30.67倍 D.46倍
 可逆反应mA(固) nB(气) =cC(气) fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示(T2>T1),下列叙述正确的是 ( ) 可逆反应mA(固) nB(气) =cC(气) fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示(T2>T1),下列叙述正确的是 ( )
A.达到平衡后,若使用催化剂,C的体积分数增大
B.达到平衡后,若使温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>c f
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动
19. 可逆反应2SO2 O2 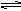 2SO3正反应速率分别用Vso2、Vo2、Vso3〔mol/L·min〕表示,逆反应速率分别用V'so2、V'o2、V'so3、〔mol/(L·min)〕表示.当反应达到化学平衡时,正确的关系是 ( ) 2SO3正反应速率分别用Vso2、Vo2、Vso3〔mol/L·min〕表示,逆反应速率分别用V'so2、V'o2、V'so3、〔mol/(L·min)〕表示.当反应达到化学平衡时,正确的关系是 ( )
A. Vo2=Vso2=Vso3 B.Vso3=V'so2
C.V'o2=1/2V'so2 D.V'so2=V'so3=V'o2
20.一定量的盐酸跟过量的铁粉反应时,为减缓反应速率而不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH(固) B.H2O C.NH4Cl(固) D.CH3COONa (固)
21.NH3氧化制HNO3时,在吸收塔里发生如下反应:
3NO2 H2O3  2HNO3 NO (正反应为放热反应) 2HNO3 NO (正反应为放热反应)
为了提高HNO3的产量,在理论上应该采取的措施是 ( )
A. 降温 B. 升温 C. 减压 D.增压
23. 一定温度时于密封容器中发生反应:mA(g) nB(g) 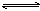 pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的是( ) pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的是( )
A.平衡向正反应方向移动 B.C气体的质量分数增大
C.气体A的转化率降低 D.m+n>p
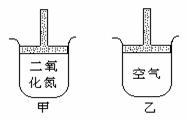 24. 常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮(2NO2 24. 常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮(2NO2  N2O4 正反应为放热反应)和空气,现分别进行下列两个实验:①将两容器置于沸水中加热 ②在活塞上都加2千克的砝码在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )。 N2O4 正反应为放热反应)和空气,现分别进行下列两个实验:①将两容器置于沸水中加热 ②在活塞上都加2千克的砝码在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )。
A.①甲>乙 ②甲>乙 B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙 D.①甲>乙 ②甲=乙
三、填空题
25.牙齿表面受到一层硬的、组成为Ca5(PO4)3OH的物质的保护,它在唾液中存在下列平衡:Ca5(PO4)3OH 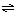 5Ca2++3PO43-+OH-,进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是 5Ca2++3PO43-+OH-,进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是
。
26.在温度为830K时,下列可逆反应及其平衡具有某种非凡性:CO H2O  CO2 H2 。测得反应物起始浓度不同时,CO的转化率α(CO)和H2O(g)的转化率α(H2O)如下表: CO2 H2 。测得反应物起始浓度不同时,CO的转化率α(CO)和H2O(g)的转化率α(H2O)如下表: |
序号 |
起始浓度 |
α(CO) |
α(H2O | |
CO |
H2O | |
1 |
2 |
3 |
60% |
| |
2 |
2 |
6 |
75% |
| |
3 |
7 |
3 |
|
70% | |