| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
①分离这两种物质混合物可采用的方法是_______________。(填序号) A.过滤 B.分液 C.蒸发 D.分馏 ②实验需要用到的主要玻璃仪器是_________________________________________________。 ⑵收集NH3气体可选用下图(Ⅰ)中的____________。(填序号,下同) 氯气的尾气吸收可用图(Ⅱ)中的______________。
(Ⅰ) (Ⅱ)
为了测定金属镁的相对原子质量,有人设计了如右图的装置。用托盘天平称出装置的总质量(包括足量的稀盐酸)为ag,将质量为bg的金属镁样品放入稀盐酸中,立即塞紧瓶塞。完全反应后称出装置的总质量为cg,从而计算出镁的相对原子质量。 ⑴镁的相对原子质量的表达式为: 。 ⑵实验中无水CaCl2的作用是:___________________________ 。 ⑶测定结果证实,误差大得不能使人接受。实验中产生了很大的误差的主要原因是: 。 ⑷又有人吸取了上面实验设计的经验,利用下面的仪器(仪器的组合),组装成一套装置,并顺利地完成了测定:
①应选用Ⅰ组中的________(填字母,下同)和Ⅱ组中的________相连接(导管的体积忽略)。选用Ⅰ组中的仪器的理由是__________________________________________________。 ②此人不再测定气体的质量而改为测定气体的体积,其原因是_________________________。 ③应根据装置的具体情况来确定称取多少金属镁。受仪器容积的限制,镁不能取用过多, 但也不能过少,镁不能取用过少的原因是________________________________________。 四、(本题包括2小题,共18分) 19.(10分)分子(或离子)的空间构型有直线形、角形、平面形、四面体形、三角锥形等。为了解释和猜测分子的空间构型,科学家在归纳了已知分子的空间构型的基础上,提出一种简单的理论模型,其理论依据是:分子中的价电子对(包括成键电子对和孤对电子)由于相互排斥作用,而取向彼此远离以减小斥力,分子尽可能采取对称的空间构型。对于ABm形分子(A为中心原子,B为配位原子),分子中的价电子对数(n)可以通过下式确定: n=
| 分子构型
| AB2
| AB3
| AB2
| AB3
| AB4
| 价电子对数
| 2
| 3
| 4
| 4
| 4
| 几何构型
| 直线形
| 平面形
| 角形
| 三角锥形
| 四面体形 |
说明:①作为配位原子,氧原子、硫原子按不提供价电子计算;
②直线形分子中最少有3个原子,平面形分子中最少有4个原子。
(1) 指出下面物质分子或离子的空间构型:
PO43-______________ ;CS2_______________ ;AlBr3(共价分子)_______________ 。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
 ________________;
________________;  ___________________。
___________________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式:
平面形分子____________,三角锥形分子____________,四面体形分子_____________。
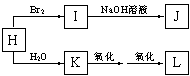
 20.(8分)已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色。A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
20.(8分)已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色。A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
⑴X的化学式为________________;
⑵写出反应①、②的离子方程式:
① 。
② 。
⑶用电子式表示G的形成过程:
_________________________________________ 。
五、(本题包括1小题,共10分)
21.(10分)化学几乎渗透于所有的行业,在考古工作中,化学就起着不可替代的作用。
⑴古墓中,石灰岩(主要成分CaCO3)上绘制的壁画在潮湿的条件下往往覆盖了一层白色薄膜,经测定为CaCO3,用化学反应方程式表示生成CaCO3的过程:
___________________________________________________________________________________。
⑵古画颜料中的铅白[Pb2(OH)2CO3]由于受空气中硫化氢气体的作用而变成溶解度极小的黑色硫化铅(反应Ⅰ),影响画面的色泽,当用过氧化氢处理后,可使硫化铅变成白色的物质(反应Ⅱ)。椐此回答下列问题:
①铅白的物质类型是______________。
②反应Ⅱ中生成的白色物质的化学式为____________ 。
③反应Ⅰ的化学反应方程式是______________________________________ 。
⑶古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重(电化腐蚀)。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,可将土壤中的SO42-还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。
① 写出该电化腐蚀的正极反应的电极反应式:______________________________________。
②文物出土前,铁器表面的腐蚀产物可能有(写化学式)_____________________________。
六、(本题包括2小题,共18分)
22.(8分)完全燃烧某一类有机物,只生成CO2和H2O,消耗氧气与所生成二氧化碳的物质的量相等。
⑴此类有机物满足的通式是 。(填序号)
①(CHx)m(H2O)n ②(COx)m(H2O)n ③Cm(H2O)n
⑵此类有机物中式量最小的A是______________。(填化学式)
⑶符合题示条件的物质B有多种,分子中均含有1个苯环,均含有16个原子。
①苯环上只有一个取代基,有杀菌、漂白作用的是________________。(写结构简式)
②不能水解,能还原银氨溶液,并能与FeCl3溶液发生显色反应的物质共有_________种。
23.(10分)化学纤维是传统三大合成高分子材料之一,其中的涤纶和维尼纶至今仍在纺织业中作为重要的原料。涤纶、维尼纶的结构简式如下:
涤纶: 
(分子链两端连接的H-、-O-CH2-CH2-OH是链的终止基团)
维尼纶:  (链的终止基团已被省略)
(链的终止基团已被省略)
工业上用煤、石油等综合利用的产物生产涤纶和维尼纶。下面是合成所需基本原料的制备方法。
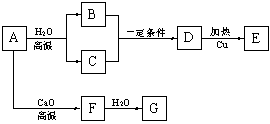
已知:A为单质,B、C、E、G、H通常情况下为气体。合成流程如下:
合成涤纶: ![]()
合成维尼纶: 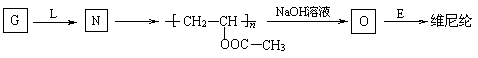
回答下列问题:
⑴G与L反应生成N的反应类型是________ ;
⑵合成涤纶的流程中,可以重复利用的物质的名称是______________ 。
⑶高分子化合物O (填“能”或“不能”)能溶于水,原因是_________________________;
⑷写出M和J反应生成涤纶的化学方程式(涤纶的结构中应含有终止基团):
____________ ;
⑸写出O与E反应生成维尼纶的化学方程式:
________________________________________ 。
七、(本题包括2小题,共18分)
24.(8分)YBa2Cu3Ox是近年来被科学家发现的一种高温超导材料。化合物中,Y、Ba、O三种元素都有固定的化合价,分别为 3、 2、-2价,而Cu是 3和 2的混合价态。欲测定该化合物的组成可用碘量法。取少量YBa2Cu3Ox样品,用稀盐酸溶解,在氮气保护下加足量的KI固体,样品中的Cu3 、Cu2 分别氧化KI(Cu3 3I-=CuI I2,2Cu2 4I-=2CuI I2),再用0.0100mol/L的Na2S2O3溶液滴定得到的I2(2Na2S2O3 I2=Na2S4O6 2NaI),到达终点时消耗Na2S2O3溶液24.00mL。另取一份质量相等的Yba2Cu3Ox样品,用稀盐酸溶解,煮沸,使其中的Cu3 全部转化为Cu2 ,冷却后用碘量法测定,到达终点时消耗Na2S2O3溶液18.00mL。
⑴求出化合物中Cu3 和Cu2 的物质的量之比。
⑵化合物的化学式为: 。
25.(10分)工业上利用NaIO3和NaHSO3反应来制取单质I2。NaIO3来源于自然界的矿物,NaHSO3则可利用硫酸工厂尾气处理(用NaOH溶液吸收SO2)的产物。
(已知:①HSO3-的还原性比I-强 ②IO3-+5I-+6H+=3I2+3H2O)
⑴配平下列化学反应方程式:
①□NaIO3 □NaHSO3—□NaI □Na2SO4 □H2SO4
②□NaIO3 □NaHSO3—□I2 □Na2SO4 □H2SO4 □H2O
 ⑵现模拟工业制取I2。在含5molNaHSO3的溶液中
⑵现模拟工业制取I2。在含5molNaHSO3的溶液中
逐滴加入NaIO3溶液。请画出加入NaIO3的物质的量
和析出I2单质的物质的量的关系曲线。
⑶若工业上要生产I22.54吨,至少需要处理标准状况下SO2的体积分数为0.224%的硫酸厂的尾气多少立方米?
|
学校 班级:_________ 学号:_______________ 姓名:_____________________ |
|
密 封 线 内 不 要 答 题 |

 高三化学第一学期期未教学情况调查答卷
高三化学第一学期期未教学情况调查答卷题号
一、二
三
四
五
六
七
总分
得分
阅卷人
考生注重:请在规定区域答题,在规定范围之外答题一律无效。
一、二、选择题(64分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
三、(22分)
17.⑴①_______________。(填序号)
② 。
⑵____________、____________。
18.⑴ 。
⑵ 。
⑶ 。
⑷① 、
。
② 。
③ 。
四、(18分)
19.⑴PO43-______________ ;CS2_______________ ;AlBr3(共价分子)_______________。
⑵ 、 。
⑶平面形分子____________,三角锥形分子____________,四面体形分子_____________。
20.⑴________________;
⑵① 。
② 。
⑶_________________________________________ 。
五、(10分)
21.⑴________________________________________________________________________。
⑵①______________ 。
②____________ 。
③______________________________________ 。
⑶①______________________________________ 。
②_____________________________。
六、(18分)
22.⑴ 。⑵______________。
⑶①________________ 。
②_________种。
23.⑴________ ;⑵______________ 。
⑶ 原因是_________________________ ;
⑷____________ ;
⑸________________________________________ 。
七、(18分)
24.⑴
⑵ 。
25.⑴①□NaIO3 □NaHSO3—□NaI □Na2SO4 □H2SO4
②□NaIO3 □NaHSO3—□I2 □Na2SO4 □H2SO4 □H2O
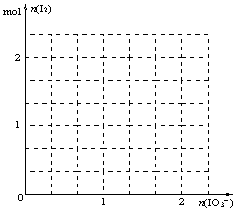 ⑵
⑵
⑶
高三化学参考答案
一、1.D 2.C 3.B 4.D 5.A 6.B 7.D 8.C
二、9.C D 10.A C 11.B 12.A C 13.D 14. B 15.A 16.B D
三、17.(10分)⑴①D (2分) ②酒精灯 蒸馏烧瓶 温度计 冷凝管 锥形瓶(4分,写4个以上给4分,少1个扣1分)
⑵B C B C(每空2分,少1个扣1分,只要有错选不得分)
18.(12分)⑴2b/a b-c(2分)
⑵吸收随H2带出的水蒸气(1分)
⑶瓶中原有的空气排出而盛满H2,且同体积空气的质量远大于H2,造成误差。(2分)
⑷① B D 便于控制反应速率(每空1分) ②测量的精确度高(2分) ③Mg过少,生成的气体少,相对误差大。(2分)
四、19.(10分)⑴四面体形 直线形 平面形(每空1分)
⑵CH3 CH3-(每空2分)
⑶BF3 NF3 CF4(每空1分)
|
⑵①2Al3 +6Cl-+6H2O ![]() 3H2↑+3Cl2↑+2Al(OH)3↓
3H2↑+3Cl2↑+2Al(OH)3↓
②Al3 +3AlO2-+6H2O=4Al(OH)3↓
⑶ ![]()
五、21.(10分)
⑴CaCO3+CO2+H2O=Ca(HCO)2 Ca(HCO3)2=CaCO3+CO2↑+H2O(每个1分)
⑵碱式盐 PbSO4 (每空1分)Pb2OH)2CO3+2H2S=2PbS+CO2+3H2O (2分)
⑶SO42-+4H2O+8e-=S2-+8OH-(2分) Fe(OH)2 FeS(每个1分)
六、22.(8分)⑴ ③ ⑵CH2O ⑶ 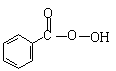 ⑷6(每空2分)
⑷6(每空2分)
23.(10分)⑴加成反应(或加成)(2分)⑵甲醇(2分)
⑶能、分子链中有许多亲水基(-OH)(每空1分)
⑷(2分) ![]()
![]()
⑸ (2分)
![]()
七、24.⑴n(Cu3 ) n(Cu2 )/2=1.2×10-3mol
n(Cu3 )/2 n(Cu2 )/2=0.9×10-3mol
列出如上两个关系式得2分。
解得n(Cu3 )=×10-4mol、n(Cu2 )=1.2×10-3mol得2分
n(Cu3 )/n(Cu2 )=1/2(1分)
⑵YBa2Cu3O7(3分)
25.⑴①2NaIO3 6NaHSO3=2NaI 3Na2SO4 3H2SO4
②4NaIO3 10NaHSO3=2I2 7Na2SO4 3H2SO4 2H2O(每个1分,共2分)
⑵(4分)
 |
⑶5×105m3(4分,过程3分,结果1分)
| |