胶体的性质及其应用
重点、难点
1. 了解分散系的概念,比较三种分散系的特征
2. 理解胶体的性质及其应用
3. 了解胶体的分类和制取
具体内容
(一)分散系
1. 分散系:一种或几种物质的微粒分散到另一种物质里形成的混合物。
2. 分散质:被分散的物质。
3. 分散剂:分散质分散在其中的物质。
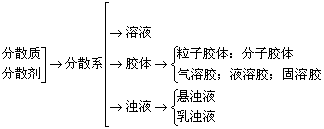
(二)三种分散系中的分散质粒子的大小
请比较小结三种分散系的相关内容,自己试一试,完成下表的空缺部分,并思考胶体的本质特征是什么?
分散系类别
溶液
胶体
浊液
分散质
微粒直径
微粒组成
分子或离子
分子集合体或高分子
巨大数目的分子集合体
外观特征
稳定性
能否透过滤纸
能否透过半透膜
实例
氨水、碘酒
肥皂水、蛋白质溶液、淀粉溶液,AgI胶体
石灰乳、牛奶
注重:三种分散系的本质区别:分散质粒子的大小不同。
(三)胶体的分类
1. 根据分散质微粒组成的状况分类: ![]()
如: ![]() 胶体胶粒是由许多
胶体胶粒是由许多 ![]() 等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。
等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。
又如:淀粉属高分子化合物,其单个分子的直径在1nm~100nm范围之内,这样的胶体叫分子胶体。
2. 根据分散剂的状态划分: ![]()
如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI溶胶、 ![]() 溶胶、
溶胶、 ![]() 溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。
溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。
(四)胶体的制备
1. 物理方法
① 机械法:利用机械磨碎法将固体颗粒直接磨成胶粒的大小
② 溶解法:利用高分子化合物分散在合适的溶剂中形成胶体,如蛋白质溶于水,淀粉溶于水、聚乙烯熔于某有机溶剂等。
2. 化学方法
① 水解促进法
思考:如何证实FeCl3溶液通过上述方法已转变成 ![]() 胶体了?
胶体了?
反应式:FeCl3 3H2O(沸)= ![]() (胶体) 3HCl
(胶体) 3HCl
注重:切勿将“胶体”两字省去,或打“↓”
② 复分解反应法
反应:
KI AgNO3=AgI(胶体) KNO3
Na2SiO3 2HCl=H2SiO3(胶体) 2NaCl
思考:若上述两种反应物的量均为大量,则可观察到什么现象?如何表达对应的两个反应方程式?
提示:
KI AgNO3=AgI↓ KNO3(黄色↓)
Na2SiO3 2HCl=H2SiO3↓ 2NaCl(白色↓)
(五)胶体的性质
1. 丁达尔效应——在暗室中,让一束平行光通过一肉眼看来完全透明的溶液,从垂直于光束的方向,可以观察到有一条光亮的“通路”,该现象称为“丁达尔效应”。丁达尔效应是粒子对光散射作用的结果,是一种物理现象。丁达尔现象产生的原因,是因为胶体微粒直径大小恰当,当光照射胶粒上时,胶粒将光从各个方面全部反射,胶粒即成一小光源(这一现象叫光的散射),故可明显地看到由无数小光源形成的光亮“通路”。当光照在比较大或小的颗粒或微粒上则无此现象,只发生反射或将光全部吸收的现象,而以溶液和浊液无丁达尔现象,所以丁达尔效应常用于鉴别胶体和其他分散系。
2. 布朗运动——在胶体中,由于质点在各个方向所受的力不能相互平衡而产生的无规则的运动,称为布朗运动。是胶体稳定的原因之一。
3. 电泳——在外加电场的作用下,胶体的微粒在分散剂里向阴极(或阳极)作定向移动的现象。胶体具有稳定性的重要原因是同一种胶粒带有同种电荷,相互排斥,另外,胶粒在分散力作用下作不停的无规则运动,使其受重力的影响有较大减弱,两者都使其不易聚集,从而使胶体较稳定。
说明:
(1)电泳现象表明胶粒带电荷,但胶体都是电中性的。
(2)在此要熟悉常见胶体的胶粒所带电性,便于判定和分析一些实际问题。
带正电的胶粒
胶体![]()
金属氢氧化物如 ![]() 、
、 ![]() 胶体
胶体
金属氧化物
带负电的胶粒
胶体![]()
非金属氧化物
金属硫化物As2S3胶体
硅酸胶体
土壤胶体
非凡:AgI胶粒随着AgNO3和KI相对量不同,而可带正电或负电。若KI过量,则AgI胶粒吸附较多I-而带负电;若AgNO3过量,则因吸附较多Ag 而带正电。当然,胶体中胶粒带电的电荷种类可能与其他因素有关。
(3)同种胶体的胶粒带相同的电荷。
(4)固溶胶不发生电泳现象。凡是胶粒带电荷的液溶胶,通常都可发生电泳现象。气溶胶在高压电的条件也能发生电泳现象。
胶体根据分散质微粒组成可分为粒子胶体(如 ![]() 胶体,AgI胶体等)和分子胶体[如淀粉溶液,蛋白质溶液(习惯仍称其溶液,其实分散质微粒直径已达胶体范围),只有粒子胶体的胶粒带电荷,故可产生电泳现象。整个胶体仍呈电中性,所以在外电场作用下作定向移动的是胶粒而非胶体。
胶体,AgI胶体等)和分子胶体[如淀粉溶液,蛋白质溶液(习惯仍称其溶液,其实分散质微粒直径已达胶体范围),只有粒子胶体的胶粒带电荷,故可产生电泳现象。整个胶体仍呈电中性,所以在外电场作用下作定向移动的是胶粒而非胶体。
4. 聚沉——胶体分散系中,分散系微粒相互聚集而下沉的现象称为胶体的聚沉。能促使溶胶聚沉的外因有加电解质(酸、碱及盐)、加热、溶胶浓度增大、加胶粒带相反电荷的胶体等。有时胶体在凝聚时,会连同分散剂一道凝聚成冻状物质,这种冻状物质叫凝胶。
胶体凝聚的方法:
(1)加入电解质
① 原因:电解质电离出的阴、阳离子与胶粒所带的电荷发生电性中和,设胶粒向斥力下降,胶粒相互结合,导致颗粒直径>10-7m,从而沉降。
② 能力:离子电荷数,离子半径
阳离子使带负电荷胶粒的胶体凝聚的能力顺序为:
Al3 >Fe3 >H >Mg2 >Na
阴离子使带正电荷胶粒的胶体凝聚的能力顺序为:
SO42->NO3->Cl-
思考:① 淀粉胶体加入少量电解质能否使其凝聚?(否!)有无电泳现象?(无!)
思考:② ![]() 胶体中分别逐渐加入HCl溶液、MgCl2溶液,现象有何异同?为什么?(加入过量盐酸,使胶体凝聚成
胶体中分别逐渐加入HCl溶液、MgCl2溶液,现象有何异同?为什么?(加入过量盐酸,使胶体凝聚成 ![]() 沉淀后又发生中和反应而溶解成FeCl3溶液,而MgCl2能使胶体凝聚而不能溶解)
沉淀后又发生中和反应而溶解成FeCl3溶液,而MgCl2能使胶体凝聚而不能溶解)
(2)加入带异性电荷胶粒的胶体
思考:将 ![]() 胶体和硅酸胶体混合有何现象?什么原因?
胶体和硅酸胶体混合有何现象?什么原因?
(3)加热、光照或射线等
加热可加快胶粒运动速率,增大胶粒之间的碰撞机会。
如蛋白质溶液加热,较长时间光照都可使其凝聚甚至变性。
你知道豆腐的生产过程吗?为什么经常加入石膏?
注重:蛋白质变性凝聚(加热、加重金属盐等不属胶体意义上的凝聚,此变性过程为化学过程。)
(六)胶体的应用
胶体的知识在生活、生产和科研等方面有着重要用途,如常见的有:
1. 盐卤点豆腐
2. 肥皂的制取分离
3. 明矾、 ![]() 溶液净水
溶液净水
4. FeCl3溶液用于伤口止血
5. 江河入海口形成的沙洲
6. 水泥硬化
7. 冶金厂大量烟尘用高压电除去
8. 土壤胶体中离子的吸附和交换过程,保肥作用
(七)胶体的提纯净化
利用渗析的方法,将胶体中的杂质离子或小分子除去。
1. 实验步骤
(1)把10mL淀粉胶体和5mLNaCl溶液的混合液体,加入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图)(半透膜可用鸡蛋壳膜、牛皮纸、胶棉薄膜、玻璃纸等制成,它有非常细小的孔,只能答应较小的离子、分子透过)。
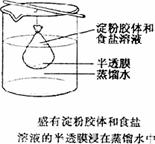
(2)2min后,用两支试管各取烧杯中的液体5mL,向其中一支试管里滴加少量AgNO3溶液,向另一支试管里滴加少量碘水,观察现象。
2. 实验现象
可以看到在加入AgNO3溶液的试管里出现了白色沉淀;在加入碘水的试管里并没有发生变化。
3. 实验结论
Cl-能透过半透膜,从半透膜袋中扩散到了蒸馏水中,淀粉不能透过半透膜,没有扩散到蒸馏水中。胶体分散质的粒子比溶液分散质的粒子大。
4. 注重事项
(1)半透膜袋要经检验未破损,否则,淀粉粒子也会进入蒸馏水。
(2)不能用自来水代替蒸馏水,否则,实验结论不可靠。
(3)一般要在2min以后再作Cl-的检验,否则,Cl-出来的太少,现象不明显。
说明:
应用实验的原理和方法,可以除去胶体溶液中的离子或小分子杂质。为了提高除杂的速度和提高除杂的程度,要定期更换蒸馏水。
应用渗析洁皿用流动水来精制胶体,若要检验半透膜袋有无损坏,则应取悬放过此袋样品的烧杯中少量溶液,向其中加入大量I2溶液,若变蓝,则可说明已损坏,淀粉胶体已透过半透膜进入水中。
思考再进一步:能否用溴水代替碘水?何故?
【典型例题】
[例1] 下列溶液不具有丁达尔现象的是( )
A. C17H35COONa溶液 B. 珂罗酊
C. I2的CCl4溶液 D. 蛋白质溶液
答案:C
解析:具有丁达尔现象是胶体的特征,故本题实际归属为分散系的类别判定,其中较不熟悉的是珂罗酊成份,它是胶棉(硝酸纤维素酯)的乙醇——乙醚溶液。由此从字面看来,四种选项似乎都称溶液,但需注重:凡是高分子化合物形成的溶液由于分散质微粒大小已达到胶体范围,故实际属胶体。C17H35COONa虽然不是高分子化合物,但分散质微粒也已达到胶体范围,所以工业上油脂经它化反应后加入大量NaCl,发生盐析,从而达到分离目的,I2属于小分子,其CCl4溶液应名付其实。常见错误是学生往往“望文生意”,或不抓住原理、规律而盲目猜测。
[例2] 设计实验,用简便方法证实明矾溶于水发生的下列变化
(1)发生水解反应且水解是一个吸热过程______________
(2)生成了 ![]() 胶体________________________
胶体________________________
(3)为什么可用 ![]() 代替明矾净水?
代替明矾净水?
答案:见解析
解析:(1)根据明矾溶于水只有Al3 发生水解,因其水解而使溶液显酸性,放可借用指示剂(石蕊)或pH试纸来测定。另要证实其水解是一个吸热过程,只须加热一段时间,比较加热前后溶液的酸性强弱。
(2)可利用丁达尔现象来检验有无胶体的生成。
(3)Fe3 同样有较大程度的水解,产生 ![]() 胶体,胶体一般具有较强的吸附能力。
胶体,胶体一般具有较强的吸附能力。
[例3] 有甲、乙、丙、丁四种液体,它们分别为 ![]() 胶体,硅酸胶体、As2S3胶体、NaOH溶液。现将有关实验现象记录如下:
胶体,硅酸胶体、As2S3胶体、NaOH溶液。现将有关实验现象记录如下:
(1)电泳:甲液体的阳极四周颜色变浅,阴极四周颜色变深
(2)将一束光通过乙,无丁达尔现象
(3)将乙慢慢加入到丙液体中,光出现凝聚后液体变清,则甲:__________乙:__________ __________ 丁:__________
答案:甲: ![]() 胶体 乙:NaOH溶液 丙:H2SiO3液体 丁:A s2S3胶体
胶体 乙:NaOH溶液 丙:H2SiO3液体 丁:A s2S3胶体
解析:本题涉及了胶体和溶液的区别、胶体的电泳和凝聚现象,常见胶体胶粒所带电的电性、酸碱中和等知识,根据电泳现象可确定A为 ![]() 胶体,乙为NaOH溶液在其余的三种物质中,只有NaOH除作为电解质作用外还可与H2SiO3胶体进一步反应,生成Na2SiO3溶液,故丙为H2SiO3液体,丁则为A s2S3胶体。
胶体,乙为NaOH溶液在其余的三种物质中,只有NaOH除作为电解质作用外还可与H2SiO3胶体进一步反应,生成Na2SiO3溶液,故丙为H2SiO3液体,丁则为A s2S3胶体。
[例4] 某种胶体在电泳时,它的胶粒向阴极移动。在胶体中分别加入下列物质:① 蔗糖溶液;② 硫酸镁溶液;③ 硅酸胶体;④ 氢氧化铁胶体不会发生凝聚的是( )
A. ①③ B. ①④ C. ②③ D. ③④
答案:B
解析:胶体的微粒是带电荷的,在电泳实验中胶体的微粒向阴极移动,说明该胶体的微粒带正电荷。要使本胶体不产生凝聚,应加入非电解质溶液如蔗糖溶液,或者加入微粒带正电荷的胶体如氢氧化铁胶体。应使学生把握胶体的凝聚原因及条件。
[例5] 某学生在做 ![]() 胶体凝聚实验时,用:① 加硅酸胶体;② 加
胶体凝聚实验时,用:① 加硅酸胶体;② 加 ![]() 胶体;③ 加
胶体;③ 加 ![]() 溶液;④ 加As2S3胶体;⑤ 加蒸馏水等五种方法,其中能观察到凝聚现象的是( )
溶液;④ 加As2S3胶体;⑤ 加蒸馏水等五种方法,其中能观察到凝聚现象的是( )
A. ①②③ B. ①③④ C. ②④⑤ D. ③④⑤
答案:B
解析: ![]() 胶体粒子带正电荷,而硅酸胶体,As2S3胶体的胶粒带负电荷,因电性相反,可以发生电中和,发生凝聚,所以①④能使
胶体粒子带正电荷,而硅酸胶体,As2S3胶体的胶粒带负电荷,因电性相反,可以发生电中和,发生凝聚,所以①④能使 ![]() 胶体凝聚。
胶体凝聚。 ![]() 是电解质也能使
是电解质也能使 ![]() 胶体凝聚。
胶体凝聚。
[例6] 下列各项操作中,不发生“先沉淀后溶解”现象的为( )
① 向饱和Na2CO3溶液中通入过量的CO2,② 向Fe(OH)3胶体中逐滴滴入过量的稀H2SO4,③ 向AgI胶体中逐滴加入过量的稀盐酸,④ 向石灰水中通入过量的CO2,⑤ 向硅酸钠溶液中逐滴加入过量的盐酸
A. ①②③ B. ②③⑤ C. ①②③⑤ D. ①③⑤
答案:D
解析:① 饱和Na2CO3中通过量CO2,反应后生成NaHCO3,因NaHCO3溶解度较Na2CO3 小,会生成沉淀,但CO2过量时不溶解;② ![]() 中加入过量的稀H2SO4,因H2SO4为电解质,能使
中加入过量的稀H2SO4,因H2SO4为电解质,能使 ![]() 胶体凝聚而沉淀,当H2SO4过量时,
胶体凝聚而沉淀,当H2SO4过量时, ![]() 而溶解。③ 生成AgI沉淀不溶于盐酸;④ CO2与石灰水反应生成CaCO3沉淀,CO2过量时可与CaCO3反应使其溶解;⑤向硅酸钠中加入盐酸后生成H2SiO3沉淀不溶于盐酸。
而溶解。③ 生成AgI沉淀不溶于盐酸;④ CO2与石灰水反应生成CaCO3沉淀,CO2过量时可与CaCO3反应使其溶解;⑤向硅酸钠中加入盐酸后生成H2SiO3沉淀不溶于盐酸。
[例7] 已知氢氧化铁胶体的是氢氧化铁胶粒吸附多余Fe3 生成的。现将氢氧化铁固体粉碎使粒子直径在1nm~100nm之间,并悬浮于水中,再向悬浊液中加入 或 适量。即可制得 ![]() 胶体。(填两类不同物质)
胶体。(填两类不同物质)
答案:加含Fe3 的盐溶液 加适量强酸溶液(加H )
解析:首先了解 ![]() 胶体粒子的结构是:许多分子的集合体并在表面选择吸附许多Fe3 。题中
胶体粒子的结构是:许多分子的集合体并在表面选择吸附许多Fe3 。题中 ![]() 粒子,悬浮于水中但表面没有吸附
粒子,悬浮于水中但表面没有吸附 ![]() ,它是不能稳定存在的。故应向悬浮液中加入含Fe3 溶液或加酸溶液使部分
,它是不能稳定存在的。故应向悬浮液中加入含Fe3 溶液或加酸溶液使部分 ![]() 和酸反应生成Fe3 。本题以制备
和酸反应生成Fe3 。本题以制备 ![]() 胶体为例,考查胶体的结构与形成。
胶体为例,考查胶体的结构与形成。
【模拟试题】
一. 选择题
1.在外加电场的作用下, ![]() 胶体粒子移向阴极的原因是( )
胶体粒子移向阴极的原因是( )
A. Fe3 带正电荷
B. ![]() 带负电吸引阳离子
带负电吸引阳离子
C. ![]() 胶体粒子吸附阳离子而带正电荷
胶体粒子吸附阳离子而带正电荷
D. ![]() 胶体吸附阴离子带负电荷
胶体吸附阴离子带负电荷
2. 某浅黄色胶体作电泳实验时,阴极四周的颜色变浅。向该胶体加入下列物质,能发生聚沉现象的是( )
A.MgSO4 B. ![]() 胶体 C. CCl4 D. H2SiO3 胶体
胶体 C. CCl4 D. H2SiO3 胶体
3. 某胶体遇盐卤(MgCl2)或石膏水易发生凝聚,而遇食盐水或Na2SO4溶液不易发生凝聚。下列有关说法中正确的是( )
A. 胶粒直径约1 nm~100nm
B. 遇BaCl2溶液或 ![]() ,胶体可发生凝聚
,胶体可发生凝聚
C. 胶体胶粒带有正电荷
D. Na 使此胶体凝聚的效果不如Ca2 ,Mg2
4. 在水泥和冶金工厂常用高压电对气溶胶作用,除去大量烟尘,以减少对空气的污染。这种做法应用的主要原理是( )
A. 电泳 B. 渗析 C. 凝聚 D. 丁达尔现象
5. 下面做法或物质用途的叙述中错误的是( )
A. 给误食用重金属盐的病人喝生牛奶以解毒
B. 硅藻土作吸附剂
C. 以无水酒精作外科消毒剂
D. 以 ![]() 代替明矾作净水剂
代替明矾作净水剂
6. 在任何条件下,运用电泳现象不能证实( )
A. 胶体粒子带何种电荷
B. 电源的正、负极
C. 胶体粒子作布朗运动
D. 胶体,有丁达尔效应
7. 胶体粒子能作布朗运动的原因是:① 水分子对胶粒的撞击;② 胶体粒子有吸附能力③ 胶粒带电;④ 胶体粒子质量小,所受重力小( )
A. ①② B. ①③ C. ①④ D. ②④
8. 下列有关渗析的说法正确的是( )
① 该操作必须要有半透膜 ② 该操作能分离胶体则反复几次
③ 渗析是胶体的一个重要性质
A. ①② B. ①②③ C. ①③ D. ①
9. 不能用有关胶体的观点解释的现象是( )
A. 在河流人海口处易形成三角洲
B. 0.01 mol·L-1 AgNO3溶液中滴入同浓度NaI溶液,看不到黄色沉淀
C. 在NaF溶液中滴入AgNO3溶液看不到沉淀
D. 同一钢笔同时使用不同牌号的墨水易发生堵塞
10. 下列实验方法(指主要操作),错误的是( )
A. 用过滤法分离KMnO4受热分解的产物
B. 用升华法分离NH4C1与碘的混合物
C. 用渗析法分离淀粉与硫酸镁的混合物
D. 用分液法分离C2H5Br和C2H5OH的混合物
11. 已知土壤胶体带负电;在土壤里施用含氮量相等的下列肥料,肥效较差的是( )
A. ![]() B. NH4HCO3 C. NH4NO3 D. NH4Cl
B. NH4HCO3 C. NH4NO3 D. NH4Cl
12. 下列可用相同的方法除去混有杂质的是( )
A. 淀粉溶液中混有少量NaCl杂质;蔗糖中混有少量NaCl杂质
B. ![]() 胶体中混有少量盐酸;淀粉溶液中混有少量KI
胶体中混有少量盐酸;淀粉溶液中混有少量KI
C. Na2CO3中混有少量NaHCO3;NaHCO3中混少量Na2CO3
D. 铁粉中混有少量硫粉;碘中混有少量NaCl
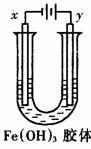
13. 如图装置,U型管中盛有 ![]() 胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )
胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )
A. x是阳极,y是阴极
B. x极四周颜色变深,y极近颜色变浅
C. x是阴极,y极四周颜色加深
D. y是阴极,x极四周颜色加深
14. 粘土胶体溶液中,粘土粒子带负电,为了使粘土粒子凝聚,下列物质中用量最少但最有效的电解质是( )
A. Na3PO4 B. ![]() C.BaCl2 D. K2SO4
C.BaCl2 D. K2SO4
15. 下列各组物质可用渗析法分离的是( )
A. NaCl和水
B. ![]() 胶体和NaCl
胶体和NaCl
C. CCl4和水
D. NH4Cl和NaCl固体混合物
16. 现有甲、乙、丙、丁和 ![]() 胶体溶液,按甲和丙、乙和丁、丙和丁、乙和
胶体溶液,按甲和丙、乙和丁、丙和丁、乙和 ![]() 胶体两两混合,均出现胶体凝聚。则胶体粒子带负电荷有胶体溶液是( )
胶体两两混合,均出现胶体凝聚。则胶体粒子带负电荷有胶体溶液是( )
A. 甲 B. 乙 C. 丙 D. 丁
二. 填空题
17. 向 ![]() 胶体中逐滴加入盐酸至过量,出现的现象是________原因是 __________。
胶体中逐滴加入盐酸至过量,出现的现象是________原因是 __________。
l8. 有甲、乙、丙、丁和Ag2S五种溶胶,按甲和乙、丙和丁、乙和丁,甲和Ag2S两两混合均出现沉淀,则上述溶胶中带负电的是
19. 在氢氧化铁胶体里加入硫酸钠饱和溶液,由于 离子的作用,使胶体形成了沉淀,这个过程称为_______。
20. 实验室制取 ![]() 胶体的方法是把__________逐滴加在__________中,继续煮沸,待溶液呈__________色时停止加热,其反应的离子方程式为__________用_____ (方法)可证实胶体已经制成,用__________方法精制胶体。如何用实验方法,证实胶体和Cl-两者已完全分离?
胶体的方法是把__________逐滴加在__________中,继续煮沸,待溶液呈__________色时停止加热,其反应的离子方程式为__________用_____ (方法)可证实胶体已经制成,用__________方法精制胶体。如何用实验方法,证实胶体和Cl-两者已完全分离?
21. 在陶瓷工业上常碰到因陶土里混有Fe2O3而影响产品质量的问题。解决方法之一是把这些陶土和水一起搅拌,使粒子直径在1 nm~100 nm之间,然后插入两根电极,接通直流电源,这时阳极聚集_________,阴极聚集_________理由是______________
22. 自来水用绿矾和氯水一起净水,请用离子方程式和简要的文字叙述说明原理_____。
【试题答案】
一. 选择题
1. C 2. AB 3. BD 4. A 5. C 6. CD 7. C
8. B 9. C 10. B 11. C 12. B 13. B 14. B
15. B 16. BC
二. 填空题
17. 先生成红褐色沉淀,后逐渐溶解形成棕黄色溶液, ![]() 胶体遇电解质产生凝聚生成
胶体遇电解质产生凝聚生成 ![]() 沉淀,再加盐酸,沉淀溶解。
沉淀,再加盐酸,沉淀溶解。
18. 乙、丙
19. SO42- 胶体的凝聚
20. 饱和FeCl3溶液,沸水,红褐色,Fe3 3H2O(沸水)= ![]() (胶体) 3H ;丁达尔效应、渗析,取半透膜内剩余的少量液体,滴加硝酸银溶液(酸化),若无白色沉淀,证实胶体与C1-已完全分离。
(胶体) 3H ;丁达尔效应、渗析,取半透膜内剩余的少量液体,滴加硝酸银溶液(酸化),若无白色沉淀,证实胶体与C1-已完全分离。
21. 带负电的胶体(粒子陶土) 带正电的胶体(Fe2O3)微粒 电泳除杂
22. 2Fe2 C12=2Fe3 2C1-
Fe3 3H2O(沸水)= ![]() (胶体) 3H
(胶体) 3H
![]() 胶粒表面积大,可以吸附水中的悬浮杂质而沉聚,从而达到净水的目的
胶粒表面积大,可以吸附水中的悬浮杂质而沉聚,从而达到净水的目的
