理科化学
本试卷分为试题卷和答题卷两部分,其中试题卷由第1卷(选择题)和第Ⅱ卷(非选择题)组成,共6页;答题卷共2页。满分100分.考试结束后将答题卡和答题卷一并交回。
可能用到的相对原子质量和常数:H1 016 Na23 Mg24 A127 K39 Fe56
HA:6.02x 1023mol—l
第I卷(选择题,共50分)
注重事项:
1.答第I卷前,考生务必将自己的姓名、考号、考试科目用铅笔准确涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后再选涂其它答案,不能答在试题卷上。
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意。)
1.金属在日常生活中用途广泛,如熔点最低的金属a常用来做温度计,而熔点最高的金属b常用来做白炽灯的灯丝,那么,a、b分别是
A.Ag、Pt B.Hg、Pt C.Hg、W D.Hg、Fe
2.下面是合成氨的简要流程图:
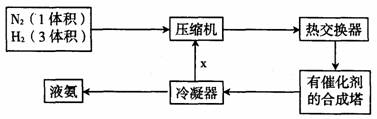
沿x路线回去的物质是
A.氮气和氢气 B.催化剂 C.氮气 D.氢气
3.下列物质不能用于自来水净化或消毒杀菌的是
A.KAl(SO4)2·12H2O B.Ca(C1O)2 C.O3 D.CuSO4·5H2O
4.下列有关合金的说法中错误的是
A.世界上最常见的,用量最大的合金是钢
C.合金的硬度一般比它各成分金属的小,熔点一般也比它各成分金属的高
D.合金可以由金属与金属或金属与非金属熔合而成
5.下列溶液肯定呈酸性是
A.含H 的溶液 B.加酚酞显无色的溶液
C.pH<7的溶液 D.c(OH—)<c(H )的溶液
6.下列反应中MnO2作氧化剂的是:①MnO2与氯酸钾混合加热 ②MnO2与浓盐酸混合加热 ③MnO2加入到双氧水中 ④MnO2与铝粉混合加热
A.①③ B.只有② C.②④ D.①②③④
7.向某溶液中加入过量盐酸,生成白色沉淀,过滤后向滤液中加入过量氨水使溶液呈碱性,又有白色沉淀生成,再过滤后,又向滤液中加入碳酸钠溶液,再次生成白色沉淀。原溶液中含有的离子是
A. MS2 、Al3 、Ca2 B. Fe2 、Ca2 、Ba2
C.Fe3 、Ba2 、Ag D.Ag 、Al3 、Ba2
8.a、b、c都是金属,a中混有c时,a先腐蚀;a与b组成原电池时,a为电池的正极。a、b、c三种金属的活动性顺序为
A.a>b>c B.b>a>c C.a>c>b D.b>c>a
9.四位同学同时进行A 3B=2C 2D的反应速率测定实验,分别测得反应速率如下:①v(A)=0.15mol/(L·s);v(B)=0.6mol/(L·s);v(C)=0.4mol/(L·s);v(D)=0.45mol/(L·s)。其中,反应进行得最快的是
A.① B.② C.③ D.④
10.一定温度下,向0.1mol·L—1氨水中加入氯化铵晶体,则溶液中随着氯化铵晶体加入而变小的是
A.c(H ) B.c(H )·c(OH—) C.c(OH—)/c(NH3·H2O) D.c(NH4 )/c(OH—)
11.将10 mL0.1 mol·L-1氨水与10 mL0.2 mol·L-1盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是
A. c(Cl-)>c(H )>c(NH4 )>c(OH-) B. c(Cl-)>c(NH4 )>c(H )>c(OH—)
C.c(NH4 )>C(Cl-)>c(OH-)>c(H ) D.c(H )>c(Cl-)>c(NH4 )>c(OH-)
12.下列各组物质充分混合后,滴入KSCN溶液显红色的是
A.FeO HCI(溶液) B.过量铁 稀硝酸
C.铁 硫酸铜溶液 D.Fe(NO3)2+盐酸
13.在t℃时,向一个被活塞密封的恒压容器中放人1molX气体和1molY气体,发生下列反应:X(g) Y(g) ![]() Q(g) 2R(g),平衡时R的含量为w%。其它条件不变,按下列配比将气体放人容器中,达到平衡时,R的含量不等于w%的是
Q(g) 2R(g),平衡时R的含量为w%。其它条件不变,按下列配比将气体放人容器中,达到平衡时,R的含量不等于w%的是
A.2molX和 2molY B.1molX、1molY和1molQ
C.1molQ和2molR D.2molR和Q、X、Y各1mol
14.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是
A、铜,氯化铁溶液 B、二氧化碳,澄清石灰水
C、稀盐酸,碳酸钠溶液 D、氢氧化钾溶液,氯化铝溶液
15.向含有少量氢氧化钠的偏铝酸钠溶液中逐滴加入盐酸至过量,能正确表示这一过程的曲线图是(图中纵坐标表示沉淀的质量,横坐标表示加入盐酸的体积)
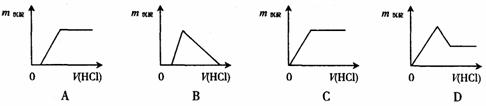
16.把一块镁铝合金溶于足量的盐酸中,再加入过量的氢氧化钠溶液,过滤,把滤渣充分灼烧,得到的固体残留物恰好跟原来合金的质量相等,则此合金中镁、铝质量之比为
A. 1:1 B. 3:2 C. 7:3 D. 1:4
17.已知铅蓄电池放电时发生如下反应:
负极:Pb-2e— SO42-=PbSO4 正极:PbO2 2e— 4H SO42—=PbSO4 2H2O
若电池在放电过程中有1mol的硫酸消耗,则该电池对外提供的电量为(已知1mol电子的电量为9.648X104C)
A.9.648X104C B.1.930x104C C.4.824X104C D.1.930X105C
18.在一个容积固定的反应器里,发生可逆反应mA(g) nB(g) ![]() pC(g) qD(g),不一定达到平衡状态的是
pC(g) qD(g),不一定达到平衡状态的是
A.体系的压强不再发生变化
B.各组分的物质的量浓度不再发生变化
C.各组分的质量分数不再发生变化
D.单位时间内,若消耗了m mol A物质,同时也消耗了q mol D物质
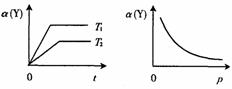 19.右下图表示可逆反应dX(g) nY(g)
19.右下图表示可逆反应dX(g) nY(g) ![]() kZ(g)在不同温度和压强下,反应物Y的转化率a的变化情况。下列判定正确的是
kZ(g)在不同温度和压强下,反应物Y的转化率a的变化情况。下列判定正确的是
A.正反应为放热反应,d n>k
B.正反应为放热反应,d n<k
C.正反应为吸热反应,d n<k
D.正反应为吸热反应,d n>k
20.向含有a mol AlCl3的溶液中加入含b mol NaOH的溶液,生成沉淀的物质的量不可能是
A.a mol B.b mol c.a/3 mol D.(4a—b)mol
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错1个,该小题就为0分。)
21.下列离子方程式书写错误的是
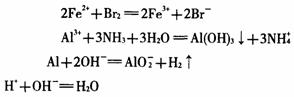 A.向氯化亚铁溶液中加入溴水
A.向氯化亚铁溶液中加入溴水
B.过量氨气通人氯化铝溶液中
C.铝片跟氢氧化钠溶液反应
D.盐酸与稀氨水反应
22.下列事实不能用勒夏特列原理解释的是
A.钢铁在潮湿的空气中轻易生锈
B.加热氯化铁溶液得不到无水氯化铁固体
C.合成NH3反应使用铁触媒并控制在500℃的高温
D.工业上生产硫酸时用过量的空气把SO2氧化为SO3
23.在一定条件下,反应CO NO2 ![]() CO2 NO达到化学平衡后,降低温度,混合气体颜色变浅(在此条件下不考虑NO2转化为N2O4的反应)。有关该反应的下列说法中正确的是
CO2 NO达到化学平衡后,降低温度,混合气体颜色变浅(在此条件下不考虑NO2转化为N2O4的反应)。有关该反应的下列说法中正确的是
A.正反应为放热反应 B.通人O2时平衡向逆反应方向移动
C.降温后CO的浓度增大 D.加压时正、逆反应速率都增大,平衡不移动
24.在常温下,下列等体积的酸和碱的溶液混合后,pH一定大于7的是
A.pH=3的硝酸和pH=11的氢氧化钾溶液
B.pH=3的盐酸和pH=11的氨水溶液
C.pH=3的硫酸和pH=11的氢氧化钠溶液
D.pH=3的醋酸和pH=11的氢氧化钡溶液
25.将盛满NO2和O2混合气体的试管倒扣在水槽中,让其充分反应,结果剩余1/6体积的气体。原混合气体中NO2和O2的体积比可能是
A. 1:1 B. 2:1 C. 5:1 D. 9:1
第Ⅱ卷(非选择题,共50分)
注重事项:
1.用钢笔或圆珠笔(蓝或黑色)将答案直接写在答题卷上.
2.答卷前将答题卷密封线内的项目填写清楚。
三、(本题包括5小题,共20分)
26.(2分)2003年4月,德意志造船公司建造出了世界上第一艘以氢氧燃料电池驱动的潜艇,它是目前世界上最先进的常规动力潜艇。该潜艇的燃料电池以KOH溶液作为电解质溶液,其能量转换率达到70%。请写出该电池的两个电极反应式:
正极 ,负极 。
27.(5分)配平下列化学方程式:
![]()
在该反应中若有2.4g镁溶解,则转移的电子数为 ,被还原硝酸的物质的量为 。
 28.(2分)甲、乙两种溶液,分别含有下列八种离子中各不相同的四种离子:OH—、NO3-、CO32—、Cl—、Ag 、K 、Mg2 、Ca2 。甲溶液能使红色石蕊试纸变蓝色,甲、乙两种溶液混合,产生白色沉淀,加人稀硝酸,沉淀减少。则甲、乙两溶液中含有的离子分别是:甲 ,乙 。
28.(2分)甲、乙两种溶液,分别含有下列八种离子中各不相同的四种离子:OH—、NO3-、CO32—、Cl—、Ag 、K 、Mg2 、Ca2 。甲溶液能使红色石蕊试纸变蓝色,甲、乙两种溶液混合,产生白色沉淀,加人稀硝酸,沉淀减少。则甲、乙两溶液中含有的离子分别是:甲 ,乙 。
29.(5分)一定温度下,在2L容器中某一反应的A、B物质的量随时间变化的曲线如右图所示,由图中数据分析得:
(1)该反应的化学方程式为 。
(2)反应开始至4min时,A的平均反应速率为 。
(3)正逆反应速率的大小关系:4min时,v正 v逆;
8min时,v正 v逆(填“>”,“<”或“=”)。
(4)若正反应是放热反应,则升高温度时B的百分含量 (填“增大”、“减小”或“不变”)。
30.(6分)在一定条件下,下列各物质之间可实现如图所示转化,部分生成物已略去。
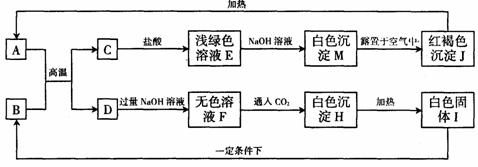
(1)A、B、E、H四种物质的化学式是:A ,B ,E ,H 。
(2)写出反应M→J的化学方程式 。
(3)写出D中加入过量NaOH溶液时发生反应的离子方程式 。
四.(本题包括2小题,共17分)
31.(8分)某学生用0.1mol/L的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
a.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞试液
b.用标准溶液润洗滴定管2![]() -
-![]()
![]()
![]()
![]() 3次
3次
c.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之布满溶液
d.取标准KOH溶液注入碱式滴定管至刻度“0”以上2 cm-3 cm处
e.调节液面至“0”或“0”以下某一刻度,记下读数
f.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度就此实验回答下列问题:
(1)正确操作步骤的顺序是(填序号字母) 。判定到达滴定终点的现象是 。
(2)上述a步操作之前,若先用待测溶液润洗锥形瓶,则使测定结果 (填“偏高”、“偏低”、“不受影响”。下同)。
(3)若称取的KOH固体中含少量NaOH,用此固体配制的标准溶液来滴定上述盐酸,则会使测定结果 。
32.(9分)无水氯化铝是白色晶体,易吸收水分,在178℃时升华。装有无水氯化铝的试剂瓶久置于潮湿的空气中,会自动爆炸并产生大量白雾。某课外爱好小组在实验室设计了如下图所示装置制取少量纯净的无水氯化铝。
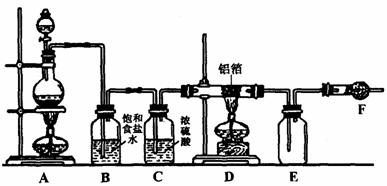
试回答下列问题:
(1)实验时A装置的分液漏斗中装的物质是 ,E中的白色固体化学式是 。
(2)写出A、D中发生反应的化学方程式:A ,D 。
(3)F中应填充的固体物质是 。其作用是 。
(4)从A装置中导出的气体,若不经过B、C装置而直接进入D管,可能对实验产生的不良后果是 。
五、(本题包括2小题,共13分)
33.(6分)将3molA气体与2 molB气体在2 L容器中混合并在一定条件下发生如下反应:2A(g) B(g) ![]() 2C(g)。达到平衡后测得容器内压强减小了28%,试计算:
2C(g)。达到平衡后测得容器内压强减小了28%,试计算:
(1)C的物质的量浓度;(2)A、B的转化率。
34.(7分)为了测定含SiO2杂质的赤铁矿中铁的含量,称取11.2 g该样品的粉末,放人到50mL3.8mol/L硫酸中充分反应,再加入4.48g铁粉,反应完全后放出气体672mL(标准状况),最后溶液中留下白色沉淀。滤出沉淀后将滤液稀释至200mL,溶液呈强酸性。假设赤铁矿中只含氧化铁和二氧化硅,试计算:
(1)铁矿石中铁的质量分数;(2)最后所得200mL溶液的pH。
第三学期末教学质量测试
理科化学参考答案和评分标准
说明:
1.本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法
或步骤解答,正确的同样给分;有错的,根据错误的性质,参照评分标准中相应的规定评分.
2.化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分.
3.化学方程式、离子方程式未配平的,都不给分.
4.计算只有最后答案而无演算过程的,不给分.
第I卷(选择题,共50分)
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意。)
1.C 2.A 3.D 4.C 5.D 6.C 7.D 8.B 9.D 10.C 11.A 12.D 13.B 14.A 15.B 16.B 17.A 18.A 19.C 20.B
二、选择题(本题包括5小题,每小题2.分,共10分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错1个,该小题就为0分.)
21.CD 22.AC 23.AD 24.B 25.BD
第Ⅱ卷(非选择题,共50分)
三、(本题包括5小题,共20分)
26.(2分,每空1分)O2 2H2O 4e— = 4OH— 2H2 4OH— - 4e— = 4H2O
27.(5分)4,10,4,1,3(2分) 1.204X1023(1分) 0.025mol(2分)
28.(2分,每空1分)OH—、CO32-、Cl-、K 、NO3-,Ag 、Mg2 、Ca2
29.(5分,每空1分)(1) 2A ![]() B (2)0.05mol/(L·min) (3)> =
B (2)0.05mol/(L·min) (3)> =
(4)减小
30.(6分,每空1分)(1)A:Fe2O3 B,Al E:FeCl2 H:Al(OH)3 (2)4Fe(OH)2
O2 2H2O = 4Fe(OH)3 (3)A12O3 2OH— = 2AlO2- H2O
四、(本题包括2小题,共17分)
31.(8分,每空2分)(1)b d c e a f 溶液由无色变成浅红色且半分钟内不褪色
(2)偏高 (3)偏低
32.(9分)(1)浓盐酸(1分) AlCl3(1分) (2)A:MnO2 4HCI(浓) ![]() MnCl2
MnCl2
Cl2↑ 2H2O (2分) D:2Al 3Cl2 ![]() 2AICl3 (1分) (3)碱石灰(或固体NaOH、
2AICl3 (1分) (3)碱石灰(或固体NaOH、
CaO等)(1分) 吸收多余的氯气以免污染空气,同时防止空气中的水蒸气进入E(2分)
(4)发生爆炸(1分)
五.(本题包括2小题,共13分)
33.(6分)解,设平衡混合物中含C的物质的量为2x

答:C的物质的量浓度为1.4mol/L;A的转化率为93.3%,B的转化率为70%
34.(7分)解:最后所得200mL溶液呈强酸性,说明整个反应硫酸过量。铁全部参加反应,一部分铁跟硫酸反应产生H2,另一部分铁还原Fe3 。
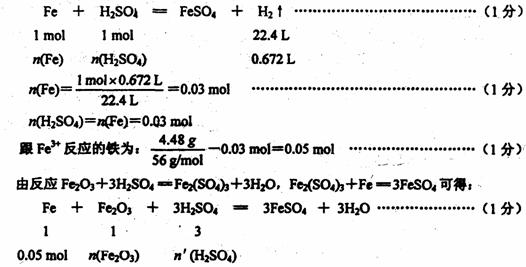
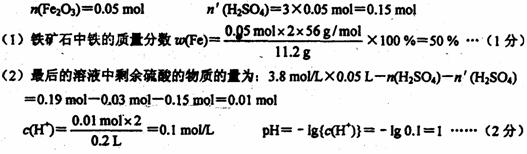
答:铁矿石中铁的质量分数为50%,最后所得200mL溶液pH----1.
(此题的评分原则是:化学方程式共2分,算出第一个答案3分,第2个答案2分)
