学科:化学
教学内容:铁和铁的化合物
【基础知识精讲】
1.原子结构与周期表位置:
 主要化合价: 2, 3
主要化合价: 2, 3
第四面期,第Ⅷ族
2.铁单质的性质
物理性质:银白色,熔沸点时,导电导热性良好,有延展性,能被磁铁吸引;
化学性质:能与非金属化合,能与水蒸气、酸反应,在冷的浓H2SO4、浓HNO3中钝化、能与盐溶液反应.
3.铁的重要化合物
氧化物:FeO、Fe2O3、Fe3O4 氢氧化物:Fe(OH)2与Fe(OH)3
盐类:FeSO4与FeCl3
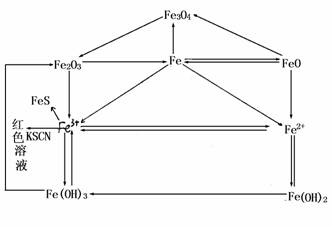
4.Fe3 离子的检验:
加SCN-溶液呈血红色或加OH-溶液出现红棕色沉淀. 铁及其化合物相互转比关系:
5.方法导引
铁是生产中应用最广泛的金属.在中学化学中是作为重要的代表元素.把握了铁及其化合物知识,很有助于全面理解金属的性质.由于铁是变价元素,情况较复杂,学习时应注重联系已学过的基础知识如氧化还原,物质结构等,并注重和主族金属元素的性质进行比较.
铁的三种价态之间的相互转化规律可总结如下:
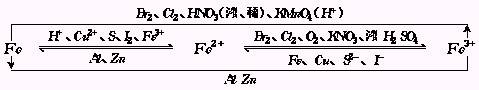
【重点难点解析】
重点:
(1)铁的化学性质——铁是常见的还原剂,在参与化学反应时,一般可失去2e-或3e-而变成Fe2 离子或Fe3 离子.
(2)铁盐和亚铁盐的转变——铁盐 ![]() 亚铁盐.
亚铁盐.
(3)Fe3 的鉴定——一般有两种方法:一是用碱溶液(得红褐色沉淀);一是用硫氰酸盐(得深红色溶液)
难点:“铁三角”之间的相互转化.
1.学习铁及其化合物的性质要注重:
(1)抓价态:从铁元素三种价态的相互转化(铁三角关系)去熟悉铁及其化合物间的氧化—还原反应规律.
(2)想属类:如铁是一种比较活泼的过渡金属,氧化亚铁、氧化铁为碱性氧化物,氢氧化亚铁、氢氧化铁为不溶性弱碱,氯化铁为强酸弱碱盐,由此去分析理解它们各自所具有的性质.
2.铁元素的原子在化学反应中,当遇弱氧化剂(如S、H 、Cu2 、I2等)时,铁只能失去最外层的两个电子,而生成 2价铁的化合物,当碰到强氧化剂(如Cl2、Br2、HNO3等)时,铁原子可以再失去次外层上的一个电子而生成 3价铁的化合物.
【难题巧解点拨】
例1:将一定量的铁粉加入含稀HNO3、Fe(NO3)3和Cu(NO3)2的混合溶液中,充分反应后过滤,将滤出的固体物质加入稀盐酸中.(1)若有气体放出,则滤液中存在的金属阳离子为 .
(2)若无气体放出,则滤液中存在的金属阳离子为 .
分析:本题考查铁的单质及化合物的性质,分析中宜从终态考虑.
据题意(1)剩余物是铁,因此与铁反应的微粒(或物质)均不能存在,溶液中金属阳离子只有Fe2 离子;(2)中剩余物为铜;与铜反应的物质均不存在,溶液中阳离子一定有Fe2 离子(铁都转化为Fe2 离子),Cu2 离子有可能存在,也可能不存在.
参考答案:(1)Fe2 (2)一定有Fe2 ,可能有Cu2 .
例2:试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.

(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).
分析:本题第一问比较简单.发生的反应为:Fe Cu2 =Fe2 Cu,Fe 2H =Fe2 H2↑
第二问是考查思维的严密性和灵敏性.由题意,反应后溶液中不含Cu2 ,所以两份试样中的铜元素全部转化为单质铜,而溶液是强酸性,则固体物中无Fe,所以m为铜的质量.故一份试样中氧化铜的质量为 ![]() ×MCuO=
×MCuO= ![]() m=
m= ![]() m.
m.
答案:(1)Fe Cu2 =Fe2 Cu Fe 2H =Fe2 H2↑
(2) ![]() m
m
例3:氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.
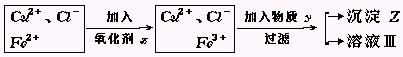
↓蒸发结晶
CuCl2·2H2O(纯)
(1)加入氧化剂X的目的是
(2)下列氧化剂中最适合本实验的是
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
(3)物质Y和沉淀Z的化学式分别是 和 .
(已知完全成氢氧化物所需PH值:Fe3 为3.7,Cu2 为6.4,Fe2 为9.6.)
分析:本题是对一个实验问题进行理论分析.
解答本题的要害是理解题中提供的一条中学未曾接触的信息的含意.由于Fe2 沉淀为Fe(OH)2的PH值与Cu2 沉淀为Cu(OH)2的PH较大,而与Fe3 沉淀为Fe(OH)3的PH相差较大,所以可以通过先将Fe2 氧化为Fe3 ,再调节溶液的PH使铁以Fe(OH)3沉淀形式而被除去.为了使加入的氧化剂不带入新的杂质,显然用H2O2最好.出于同样的考虑,加入y调节溶液PH值时,应选用能与H 反应,而溶解度较小的物质如CuO为好,CuO稍多不会带入新杂质也不会使PH值升高太多而使Cu2 沉淀.
答案:(1)使溶液A中的Fe2 氧化成Fe3 ; (2)A (3)Y:CuO或Cu(OH)2 Z:Fe(OH)3
【命题趋势分析】
常考知识点:
1.铁单质物理、化学性质属于常考知识,多为选择题或填空题,难度偏低.
2.铁的化合物性质,Fe3 离子检验和铁三角知识每年必考,选择、填空均有,难度居中.
3.综合科目考查:可结合生物学命题,如铁元素与人体健康的关系.
4.有关实验考查.
【典型热点考题】
例1:在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2 B.Fe3 C.Fe2 D.H
分析:解此题要把握单质铁有还原性能和Cu2 、H 、Fe3 反应.另外,铁能被磁铁吸引是铁的一种重要物理性质.现在Fe单质有剩余则Cu2 、H 、Fe3 分别被还原为H2、Cu、Fe2 故溶液中Fe2 最多,答案为C.
例2:将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是( )
A.FeS B.Fe2O3 C.FeCl3 D.Fe2(SO4)3
分析:由题意可知,A中的Fe2 与SCN-结合没有颜色改变,但通入Cl2后发生下列反应,生成Fe3 ,溶液变为红色.2Fe2 Cl2 ![]() 2Fe3 2Cl-,Fe3 SCN-
2Fe3 2Cl-,Fe3 SCN- ![]() [Fe(SCN)]2 .答案为A.
[Fe(SCN)]2 .答案为A.
例3:向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe HNO3 ![]() Fe(NO3)3 NO↑ H2O
Fe(NO3)3 NO↑ H2O
(1)写出这两个阶段反应的离子方程式.
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式.
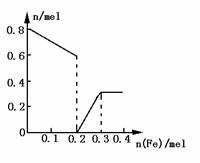
(3)在图中画出溶液中Fe2 、 ![]() 离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
分析:铁与稀硝酸反应规律
①Fe 4HNO3 ![]() Fe(NO3)3 NO↑ 2H2O
Fe(NO3)3 NO↑ 2H2O
②3Fe 8HNO3 ![]() 3Fe(NO3)2 2NO↑ 4H2O
3Fe(NO3)2 2NO↑ 4H2O
(1)当 ![]() ≤
≤ ![]() 时,按反应①进行;
时,按反应①进行;
当 ![]() ≥
≥ ![]() 时,按反应②进行.
时,按反应②进行.
当 ![]() ≤
≤ ![]() ≤
≤ ![]() 时,则①②两反应都发生,且Fe、HNO3均反应完全.
时,则①②两反应都发生,且Fe、HNO3均反应完全.
(2)上述反应可以认为先发生反应①,若Fe有剩余则发生2Fe(NO3)3 Fe ![]() 3Fe(NO3)2.
3Fe(NO3)2.
答案为:
(1)Fe 4H ![]()
![]() Fe3 NO↑ 2H2O
Fe3 NO↑ 2H2O
2Fe3 Fe ![]() 3Fe2 .
3Fe2 .
(2)①加入Fe粉为0~0.2mol时,存在形式为Fe3 .
②加入铁粉为0.2~0.3mol时,存在形式为Fe2 和Fe3
③加Fe粉为n(Fe)≥0.3mol时,存在形式为Fe2 .
(3)如下图.

【同步达纲练习】
1.铁处于周期表的( )
A.第三周期VⅢB族 B.第三周期VⅢ族
C.第四面期VⅢA族 D.第四面期VⅢ族
2.下列化合物中,不能通过单质直接化合生成的是( )
A.FeS B.FeCl2 C.FeCl3 D.Na2O2
3.常温下,能用铁制容器盛放的液体是( )
A.浓氨水 B.CuSO4溶液
C.FeCl3溶液 D.浓H2SO4
4.下列盐能使稀NaOH溶液的PH变小的是( )
A.FeCl3 B.K2CO3 C.KCl D.CuSO4
5.下列溶液长期暴露在空气中会变质的是( )
A.CuSO4溶液 B.Na2SiO3溶液
C.FeSO4溶液 D.NaCl溶液
6.在下列溶液中,若加入过量氨水或过量的氢氧化钠溶液,都产生沉淀,若加入铁粉溶液增重的是( )
A.MgCl2 B.FeCl2 C.AlCl3 D.FeCl3
7.把过量的氯气通入FeBr2溶液中反应后生成物是( )
A.FeCl2 B.FeCl3和Br2
C.FeCl2和Br2 D.FeCl3和FeBr3
8.能与大量Fe3 共存的是( )
A.Fe B.S2- C.Cu2 D.Cu
9.为除去FeSO4溶液中的Fe2(SO4)3和CuSO4杂质,可选用的试剂是( )
A.NaOH B.铁粉 C.氨水 D.氯水
10.使Fe,Cu,Fe2 、Fe3 和Cu2 共处于同一容器内反应后铁有剩余,那么容器内还应存在( )
A.Cu,Fe3 B.Fe2 ,Fe3 C.Cu,Cu2 D.Fe2 、Cu
11.28克铁和100ml0.5mol/LFe(NO3)3溶液混和,则( )
A.Fe完全被氧化 B.Fe部分被氧化
C.溶液中有Fe3 、Fe2 D.溶液中只有Fe2
12.由于被空气中O2氧化而变黄色的是( )
A.浓HNO3久置变黄色 B.FeSO4溶液久置变黄色
C.KI溶液久置变黄色 D.工业盐酸呈黄色
13.下列化学方程式或离子方程式符合反应事实的是( )
A.4Fe 3O2 ![]() 2Fe2O3
2Fe2O3
B.Cu 2Fe3 ![]() Cu2 2Fe2
Cu2 2Fe2
C.Fe 4HNO3(稀) ![]() Fe(NO3)2 2NO2↑ H2O
Fe(NO3)2 2NO2↑ H2O
D.2Fe2 4Br- 3Cl2 ![]() 2Fe3 2Br2 6Cl-
2Fe3 2Br2 6Cl-
14.某溶液中可能存在Mg2 、Fe2 、Fe3 ,加入NaOH溶液,开始时有白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,下列结论中正确的是( )
A.一定有Fe2 ,一定没有Fe3 、Mg2
B.一定有Fe3 存在,一定没有Fe2 、Mg2
C.一定有Fe3 ,可能有Fe2 ,一定没有Mg2
D.一定有Fe2 ,可能有Mg2 ,一定没有Fe3
15.将大量铁粉溶于少量稀HNO3中,过滤后,所得溶液的离子浓度大小排列正确的是( )
A.[ ![]() ]>[Fe3 ]>[H ]>[OH-] B.[
]>[Fe3 ]>[H ]>[OH-] B.[ ![]() ]>[Fe2 ]>[H ]>[OH-]
]>[Fe2 ]>[H ]>[OH-]
C.[Fe3 ]>[ ![]() ]>[H ]>[OH-] D.[Fe2 ]>[
]>[H ]>[OH-] D.[Fe2 ]>[ ![]() ]>[OH-]>[H ]
]>[OH-]>[H ]
16.下列各组阳离子氧化性按递减顺序排列的是( )
A.Cu2 、Fe2 、Ag 、Zn2 B.Fe2 、Ag 、Zn2 、Cu2
C.Ag 、Cu2 、Fe2 、Zn2 D.Ag 、Fe2 、Cu2 、Zn2
17.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01mol的混和溶液中,加入0.015mol的铁粉,经充分搅拌后,产生的变化是( )
A.铁溶解,没有任何金属生成
B.铁溶解,析出银,且溶液中不含有Fe3
C.析出0.01molAg和0.01molCu
D.析出0.01molAg和0.005molCu
18.将一定量的铁粉和Fe(OH)3的混和物在O2中燃烧至质量不再改变为止,发现加热前后混和物的质量无变化,则原混和物中铁和Fe(OH)3的物质的量之比为( )
A.2∶1 B.3∶2 C.81∶64 D.28∶55
19.将镁粉撒入FeCl3溶液中可观察到的全部现象是( )
①有气泡产生 ②有红褐色沉淀 ③镁粉逐渐溶解,溶液由棕黄色逐渐变成淡绿色
A.①正确 B.②错误 C.①②③ D.以上都不对
20.用下列方法制取相同质量的Fe(NO3)3,消耗HNO3的量最少的是( )
A.Fe HNO3(稀) B.FeO HNO3(稀)
C.Fe(OH)3 HNO3(稀) D.FeS HNO3(稀)
21.下列物质分别和100克15%的盐酸反应后,所得溶液的物质的量浓度最小的为( )
A.Fe B.FeO C.Fe(OH)2 D.Fe(OH)3
22.将8.4克铁粉和3.2克硫粉混和隔绝空气加热,使之充分反应,再将反应后的物质与足量的稀H2SO4反应,可得到气体体积(标况下)是( )
A.1.12L B.2.24L C.3.36L D.都不对
23.由FeO、Fe2O3和Fe3O4组成的混合物,测得其铁元素与氧元素的质量比为21∶8,则混合物中FeO、Fe2O3和Fe3O4的物质的量之比可能是( )
A.1∶2∶1 B.2∶1∶1 C.1∶1∶1 D.2∶2∶5
24.在含有ngHNO3的稀溶液中,加入mgFe粉,充分反应后,Fe全部溶解,生成气体NO,已知有 ![]() gHNO3被还原,则n∶m不可能是( )
gHNO3被还原,则n∶m不可能是( )
A.4∶1 B.2∶1 C.3∶1 D.9∶2
25.由FeSO4和Fe2(SO4)3组成的混合物中,含硫为a%,则所含铁的质量百分含量为( )
A.3a% B.(100-2a)% C.1-3a% D.20%
26.A,B,C是中学化学中常见的单质,甲、乙两化合物在常温下分别为黑色晶体和无色液体.这些化合物和单质之间的关系如图所示.
据此推断:
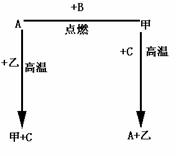
(1)若元素A有可变化合价,则单质A的化学式为 ,甲的化学式为 .
(2)根据金属活动顺序判定单质A和单质C活动性强弱:A c(填>或<=,简述甲 C ![]() A 乙反应如何才能充分进行 .
A 乙反应如何才能充分进行 .
(3)甲还能与一种常见金属在一定温度下发生反应,并放出大量热,写出该反应的化学方程式 .
27.在Fe(OH)3中,逐滴加入HI稀溶液,会发生一系列变化,请简述原因.
(1)固体溶解,溶液显黄色,原因是 ;有关离子方程式为 .
(2)最后溶液颜色加深,原因是 ;有关离子方程式为 .
28.有一黑色固体A,在氧气中焙烧,得红棕色固体B和气体C.将A加入HCl中,得到D气体和E溶液.在E溶液中加足量NaOH溶液,得到白色沉淀,将该白色沉淀取出置于空气中,然后在空气中加热,可得到B,回答下列问题:
(1)写出A、C、D的化学式:A ,C ,D .
(2)白色沉淀在空气中变化的现象是: ,其化学方程式为 .
29.等物质的量的稀HCl和稀H2SO4各100ml分别加入等质量的铁粉,反应完成后,生成H2的体积比为3∶4,若将H2SO4反应后的溶液稀释至200ml,测得溶液的PH值为1,试求HCl的物质的量浓度.
30.在100mlFeCl3溶液中通入H2S气体2.24升(标况)反应后,再加入过量铁粉,溶液中有0.6mol金属离子,求原来的FeCl3溶液的物质的量浓度.
【素质优化练习】
1.现有2mol/L的盐酸和硫酸各100ml,分别加入等质量的铁粉,反应结束时,所生成的气体质量比为2∶3,则往盐酸中加入铁粉的质量为(克)( )
A.2.8 B.5.6 C.8.4 D.16.8
2.所有氮的氧化物都能跟灼热的铁粉按下式反应:4NxOy 3yFe ![]() yFe3O4 2xN2.若将0.2molNXOy通过50克灼热的铁粉,反应完全后恰好生成0.1molN2和0.1molFe3O4,则NxOy的分子式为( )
yFe3O4 2xN2.若将0.2molNXOy通过50克灼热的铁粉,反应完全后恰好生成0.1molN2和0.1molFe3O4,则NxOy的分子式为( )
A.NO B.NO2 C.N2O D.N2O5
3.某溶液中有NH 4、Mg2 、Fe2 和Al3 四种离子,若向其中加入过量的NaOH溶液,微热并搅拌、再加入过量盐酸,溶液中大量减少的阳离子是( )
A.NH 4 B.Mg2 C.Fe2 D.Al3
4.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )
A.硫酸 B.氯水 C.硝酸锌 D.氯化铜
5.某人设想利用①3FeCl2 4H2O ![]() Fe3O4 6HCl H2
Fe3O4 6HCl H2
②Fe3O4 ![]() Cl2 6HCl
Cl2 6HCl ![]() 3FeCl3 3H2O
3FeCl3 3H2O ![]() O2 ③3FeCl3
O2 ③3FeCl3 ![]() 3FeCl2
3FeCl2 ![]() Cl2这三个反应的联合与循环,主要用来生产能解决环境和能源问题的某种气体,该气体是( )
Cl2这三个反应的联合与循环,主要用来生产能解决环境和能源问题的某种气体,该气体是( )
A.O2 B.Cl2 C.HCl D.H2
6.向一定量的FeO、Fe、Fe3O4的混合物中加入100ml1mol·L-1的盐酸,恰好使混合物完全溶解,放出224ml(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同的质量的此混合物,能得到铁的质量是( )
A.11.2g B.5.6g C.2.8g D.无法计算
7.把铁放入FeSO4溶液中,能保证溶液中的铁离子以 2价形式存在.含铁的FeSO4溶液在放置过程中,Fe2 的物质的量浓度(忽略溶液的挥发)( )
A.增加 B.减小 C.不变 D.无法确定
8.在浅绿色的Fe(NO3)2溶液中存在如下平衡:Fe2 2H2O ![]() Fe(OH)2 2H ,若向该溶液中滴加足量的盐酸,则溶液的颜色( )
Fe(OH)2 2H ,若向该溶液中滴加足量的盐酸,则溶液的颜色( )
A.变黄 B.绿色更深
C.绿色更浅 D.无变化
9.为防止FeCl2溶液变质,应加入一定量的( )
A.铁钉和稀H2SO4 B.铁钉和稀HCl
C.铁钉 D.氧化亚铁和盐酸
10.将mg铁粉和硫化亚铁组成的混合物溶解在足量盐酸中,结果得到ng沉淀,则原混合物中FeS的质量为( )
A.5m B.m-5n C.m- ![]() n D.
n D. ![]() n
n
11.砖瓦是用含铁元素等杂质的粘土隔绝空气烧制而成的,当烧窑作业临近结束时,若用淋洒水的办法来降低温度,窑内处于还原性气氛,砖块中的铁以氧化亚铁的形式存在,因而砖呈青色.若用捅开窑顶自然冷却的办法,砖就变成了红色.
(1)从化学角度看,砖瓦呈红色的原因是 .
(2)现有一块红砖,实验台上有浓H2SO4、3mol·L-1的盐酸、0.1mol·L-1的KSCN溶液,0.1mol·L-1的FeCl3溶液、0.01mol·L-1的NaOH溶液、蒸馏水等试剂,请选用中学化学常用仪器,设计一个实验,用最简捷的方法验证红砖中含有三价铁.(简述实验步骤,所用仪器、产生现象、所得结论)
12.在装有固体A的试管中加入无色溶液B,此时A未溶解.但加入一定量的水,A即逐渐溶解.并有气体C生成,溶液变为浅绿色.将C与空气的混合气体再通入该试管的溶液中,溶液颜色很快加深.请填写下列空白:
(1)B的化学式是 .
(2)A加水后才溶解,其理由是 .
(3)加水后A溶于B的化学方程式是 .
13.A、B、C、D为四种单质,常温时,A、B是固体,C、D是气体.E、F、G、H、J为五种化合物,A与B反应其产物E不溶于水,F为气体,且极易溶于水得无色溶液,B和C反应产物H溶于水得黄色溶液.其反应的转化关系如下图所示:
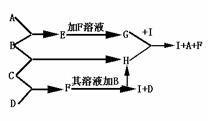
(1)判定名称:A 、B 、C 、D
(2)写出G H ![]() I A F的离子方程式 .
I A F的离子方程式 .
14.在100mlFeBr2溶液中,通入2.24L的标准状况下的Cl2,充分反应后,溶液中有 ![]() 的Br-被氧化成溴单质.求原FeBr2溶液的物质的量浓度.
的Br-被氧化成溴单质.求原FeBr2溶液的物质的量浓度.
15.用6mol/L的H2SO4溶解FeS和Fe(OH)3的混和物28.3克,得到1.6克淡黄色沉淀,求所消耗的稀H2SO4溶液的体积是多少毫升?
【生活实际运用】
1.工业上用水煤气法制还原剂,反应物为焦碳与水蒸气,人假如不小心吸入生成物气体,则会导致煤气中毒,严重的会导致死亡,这是为什么?用1mol焦炭与足够水蒸气充分反应,生成的还原剂可以还原多少克FeO和CuO的混合物(已知这种混合物的平均式量为78)?
2.希尔(HillR)将分离出的叶绿体加到草酸高铁钾盐溶液中,经过光照以后放出O2,同时草酸高铁被还原成草酸低铁.
4Fe3 2H2O ![]() 4Fe2 4H O2↑
4Fe2 4H O2↑
试回答下列问题:
(1)希尔反应 (“是”或“不是”)光反应.
(2)希尔实验中每生成1molO2,电子转移数目为 .
(3)希尔实验主要意义是 .
3.录像带用的磁粉中有CoFe3-xO3 x,其中钴和铁可有 2、 3的各某一种价态,正确的是( )
①x=1 ②x=2 ③含 ![]() ④含
④含 ![]() ⑤含
⑤含 ![]() ⑥含
⑥含 ![]()
A.①③⑤ B.①③⑥ C.②③⑤ D.②③⑥
答案为B.
4.铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,已知它的氧化性强于KMnO4,在反应中被还原为Fe3 ,将它溶入浑浊的泥水中,既能起杀菌消毒作用,又能使泥沙沉降,试回答:
(1)配平制取铁酸钠的反应方程式:
Fe(NO3)3 NaOH Cl2— Na2FeO4 NaNO3 NaCl H2O
该反应的还原产物是 .
(2)铁酸钠能沉降泥沙的原因是 .
【知识验证实验】
1.“自燃”铁粉的制备
化学原理:极细的纯铁粉遇空气能激烈发生氧化反应,放出的热量使铁粉自行“燃烧”起来.其反应的化学方程式为:
4Fe(S) 3O2(g) ![]() 2Fe2O3(S) Q·KJ.
2Fe2O3(S) Q·KJ.
这种极细的纯铁粉,常采用草酸亚铁晶体隔绝空气时强热分解方法制得:
Fe(COO)2·2H2O ![]() Fe 2CO2↑ 2H2O↑
Fe 2CO2↑ 2H2O↑
草酸亚铁晶体的制取,可用1mol/L的草酸溶液和1mol/LFeSO4溶液等体积混合,反应后可析出黄色的草酸亚铁晶体:
FeSO4 HOOC-COOH 2H2O ![]() Fe(COO)2·2H2O↓ H2SO4
Fe(COO)2·2H2O↓ H2SO4
实验步骤:
①1mol/LFeSO4溶液和1mol/L草酸溶液的配制:先称取27.8g硫酸亚铁晶体,溶解于水并配成100ml溶液.再称取12.6g草酸晶体,溶解于水也配成100毫升溶液.
②制取草酸亚铁晶体:把配制好的草酸溶液沿烧杯壁慢慢倒入上述配制好的FeSO4溶液中,充分反应后,由抽滤法进行过滤,并用蒸馏水洗涤所得黄色晶体多次.将洗涤后的黄色晶体放入50℃烘箱中烘干、备用.
③高温加草酸亚铁晶体制取纯铁粉.
取一内径6-8mm玻璃管,在酒精喷灯上将导管一端烧至熔融呈试管状.冷却后把上述制得的草酸亚铁晶体,从玻璃管的另一管口小心倒入(约占玻璃管容积的 ![]() ),然后立即用喷灯把玻璃管口烧软,并抽拉制成尖嘴状.最后用灯焰加热玻璃管有药品部位,使草酸亚铁充分反应.这时应将玻璃管口向上方,有利于生成的水蒸气和CO2排出管内.当管内粉末完全变黑,并不再有气体逸出时,立即烧熔管口封闭,即能制得能自燃的铁粉.
),然后立即用喷灯把玻璃管口烧软,并抽拉制成尖嘴状.最后用灯焰加热玻璃管有药品部位,使草酸亚铁充分反应.这时应将玻璃管口向上方,有利于生成的水蒸气和CO2排出管内.当管内粉末完全变黑,并不再有气体逸出时,立即烧熔管口封闭,即能制得能自燃的铁粉.
④铁粉自燃.
打开玻璃管口,把管内制得的极细、高纯度的铁粉倒撒在一张干净的纸上,会发生希奇的燃烧现象.
思考问题:
①怎样保证配制的FeSO4溶液不会混有Fe3 ?
②假如把草酸亚铁晶体放在试管内加强热分解,能否制得这种“自燃”铁粉?为什么?
2.制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,最后将d中液溴滴入100℃~120℃的D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.请回答以下问题:
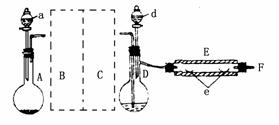
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性?答: .
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为 .若在A中盛固体CaCO3,a中盛6mol/L的盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为 ,C为 .
(3)实验时,装置D和E的橡皮塞最好用铅箔包住,原因是 .
(4)反应过程中要不断通入CO2,其主要作用是:① ;②
(5)E中的反应为:2Fe 3Br2 ![]() 2FeBr3
2FeBr3
2FeBr3 ![]() 2FeBr2 Br2↑此实验中溴化亚铁的产率为
2FeBr2 Br2↑此实验中溴化亚铁的产率为
(6)为防止污染空气,实验时应在F处连接盛 .
本题参考答案:(1)关闭d的活塞,夹紧C—D间的胶管,将F出口导管插入水中,然后将D用手捂住(或用酒精灯微热),若导管口F处有气泡冒出,松开手后水又回到导管中,则证实D装置不漏气.
(2)3Fe 4H2O(气) ![]() Fe3O4 4H2;装有NaHCO3饱和溶液的洗气瓶;装有浓H2SO4的洗气瓶.
Fe3O4 4H2;装有NaHCO3饱和溶液的洗气瓶;装有浓H2SO4的洗气瓶.
(3)Br2蒸气会腐蚀胶塞.
(4)①用CO2把反应容器中空气赶净;②将Br2蒸气带入反应器中.
(5)37.04% (6)NaOH溶液
【知识探究学习】
同学们在学习本节时,应复习初中化学中初步学习的关于铁的知识,如铁的性质、几种铁合金、生铁和钢的冶炼等.然后在这些知识的基础上,结合元素周期律、氧化还原反应等知识,进一步学习铁及其化合物的性质.
1.铁氧体法是处理含铬有毒废水的常用方法.其原理是:用FeSO4把废水中Cr2O72-离子还原为Cr3 离子,并通过调节PH值,使生成物组成符合类似于Fe3O4(铁氧体)的复合氧化物Cr3 xFe3 2-xFe2 O4.
问:处理废水时,需加至少为废水中铬(用CrO3表示)的质量多少倍的固体FeSO4·7H2O?实际处理时可能怎样?
分析:本题是新信息与已有知识结合类型的能力性测试题,要求具有较强的观察能力及逻辑思维能力.Cr3 xFe3 2-xFe2 O4就是R3O4,即M2O3·FeO,其中M3 有一部分是Fe3 ,另一部分是Cr3 .
那么Cr3 、Fe3 从哪里来?有何比例呢?
由题意知发生的反应式为:
Cr2O72- 6Fe2 14H ![]() 2Cr3 6Fe3 7H2O
2Cr3 6Fe3 7H2O
从反应不难看出n(Cr3 )∶n(Fe3 )=1∶3.要符合M2O3·FeO的组成,即n(M3 )∶n(Fe2 )=2∶1,当有4molM3 (1molCr3 和3molFe3 )时,应还需2molFe2 ,所以一共需要用5molFeSO4·7H2O.
故加入FeSO4·7H2O的质量为CrO3的倍数为:
![]() =
= ![]() =13.9
=13.9
实际上用量可能要比理论值大,因为绿矾比较轻易被氧化而变质.
2.Fe2 和Fe3 的相互转化
Fe2 有还原性,高锰酸钾、重铬酸钾、过氧化氢等氧化剂能把它氧化成Fe3 :
MnO-4 5Fe2 8H =Mn2 5Fe3 4H2O
![]() 6Fe2 14H =2Cr3 6Fe3 7H2O
6Fe2 14H =2Cr3 6Fe3 7H2O
H2O2 2Fe2 2H =2F3 2H2O
在酸性溶液中,空气中的氧也能把Fe2 氧化:
4Fe2 O2 4H =4Fe3 2H2O
在碱性溶液中,Fe2 的还原性更强,它能把NO-3和NO-2还原成NH3,能把Cu2 还原成金属铜.Fe3 具有氧化性,它能把I-氧化成I2:
2Fe3 2I-=2Fe2 I2
在无线电工业上,常利用FeCl3溶液来刻蚀铜,制造印刷线路,它们反应的化学方程式是:
2Fe3 Cu=2Fe2 Cu2
因此,铜在氯化铁溶液中能作还原剂,而FeCl3是氧化剂.
Fe3 在酸性溶液中轻易被H2S、SnCl2等还原成Fe2 :
2Fe3 H2S=2Fe2 S↓ 2H
2F3 Sn2 =2Fe2 Sn4
Fe3 还能被金属铁还原:
2Fe3 Fe=3Fe2
在亚铁盐溶液中加入铁钉可防止Fe2 被氧化为Fe3 .
3.Fe2 和Fe3 的颜色
Fe2 在水溶液中通常以水合离子[Fe(H2O)6]2 形式存在,呈淡绿色,并存在下列平衡:
[Fe(H2O)6]2 H2O ![]() [Fe(H2O)5OH] H2O
[Fe(H2O)5OH] H2O
这个平衡的pK=9.5,水解的程度很小,溶液近于中性.
Fe3 在酸性溶液中,通常以淡紫色的[Fe(H2O)6]3 形式存在.三氯化铁以及其他 3价铁盐溶于水后都发生显著的水解,实质是 3价水合铁离子的水解.只有在PH=0左右时,才有[Fe(H2O)6]3 存在(但由于有阴离子的存在,会生成其他的络离子,影响淡紫色的观察).当PH为2~3时,水解趋势很明显.它们的水解平衡如下:
[Fe(H2O)6]3 H2O ![]() [Fe(H2O)5(OH)]2 H3O
[Fe(H2O)5(OH)]2 H3O
K=10-3.05
[Fe(H2O)5(OH)]2 H2O ![]() [Fe(H2O)4(OH)2] H3O
[Fe(H2O)4(OH)2] H3O
K=10-3.26
生成的碱式离子呈黄色,它可聚合成二聚体:
2[Fe(H2O)6]3 ![]() [Fe2(H2O)8(OH) 2]4 2H3O
[Fe2(H2O)8(OH) 2]4 2H3O
K=10-2.91
二聚体是借OH-为桥把2个Fe3 连结起来形成的多核络离子.溶液的PH越高,水解聚合的倾向越大,最后逐渐形成胶体,析出红综色水合氧化铁沉淀.

参考答案:
【同步达纲练习】
1.D 2.B 3.AD 4.AD 5.BC 6.D 7.B 8.C 9.B 10.D 11.BD 12.BC
13.BD 14.D 15.B 16.C 17.D 18.C 19.C 20.C 21.D 22.C 23.CD 24.B 25.C
26.(1)Fe Fe3O4 (2)>;通入过量H2
(3)3Fe3O4 8Al ![]() 9Fe 4Al2O3
9Fe 4Al2O3
27.(1)H 与Fe(OH)3发生中和反应;
3H Fe(OH)3 ![]() Fe3 3H2O
Fe3 3H2O
(2)I-与Fe3 发生氧化还原反应生成I2
2I- 2Fe3 ![]() 2Fe2 I2
2Fe2 I2
28.(1)FeS、SO2、H2S
(2)白色沉淀逐渐变成灰绿色,最后变成红褐色.
4Fe(OH)2 O2 2H2O ![]() 4Fe(OH)3
4Fe(OH)3
29.0.3mol·l-3
30.4mol/L
【素质优化练习】
1.C 2.B 3.AC 4.BC 5.D 6.C 7.A 8.A 9.B 10.BD
11.(1)捅开窑顶,空气进入窑内,铁元素被氧化生成Fe2O3而呈红色.
(2)砸碎红砖,取少量放入研钵内,研成粉末,取该粉末放入试管中,向其中加入3mol·L-1的盐酸,振荡,静置,然后加入几滴KSCN溶液,溶液变红色证实Fe3 存在.
12.(1)H2SO4 (2)浓H2SO4使Fe钝化,稀H2SO4使Fe溶解
(3)Fe H2SO4 ![]() FeSO4 H2↑
FeSO4 H2↑
13.(1)S、Fe、Cl2、H2
(2)H2S 2Fe3 ![]() S↓ 2Fe2 2H
S↓ 2Fe2 2H
14.1.2mol·L-1
15.①若FeS过量 V=50ml ②若Fe(OH)3过量时,V=55.8ml
【生活实际运用】
1.C H2O ![]() CO H2,水煤气的生成物中有CO,它与血红蛋白的结合力远远大于O2与血红蛋白的结合力,且结合时间很长不易分离,故当吸入CO时,血红蛋白就无法与O2结合,从而血液无法运输O2,导致人体缺氧,这就是煤气中毒,严重的导致死亡. 156克
CO H2,水煤气的生成物中有CO,它与血红蛋白的结合力远远大于O2与血红蛋白的结合力,且结合时间很长不易分离,故当吸入CO时,血红蛋白就无法与O2结合,从而血液无法运输O2,导致人体缺氧,这就是煤气中毒,严重的导致死亡. 156克
2.(1)不是 (2)2.408×1024个
(3)证实光合作用中O2的来源是水分子的分解.
3.B 4.(1)2,16,3,2,6,6,8;NaCl (2)还原产物Fe3 水解生成Fe(OH)3可净水.
