(考试范围第一章~第四章,满分150分)
班级 姓名 成绩
可能用到的元素的相对原子质量:
H—1 C—12 N—14 O—16 Na—23 Mg—24 P—31 S—32 Fe—56
一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意。)
1.不能由单质直接化合而得到的化合物是 ( )
A. FeCl2 B. Al2S3 C. CuCl2 D. Mg3N2
2.下列物质间发生化学反应,反应产物只能有一种的是 ( )
A. H2S+O2 B. P+Cl2 C. Al+O2 D. Na+O2
3.下列物质的分子式(或化学式)错误的是 ( )
A. 重晶石 BaCO3 B. 绿矾 FeSO4·7H2O
C. 白磷 P4 D. 明矾 K2SO4·Al2(SO4)3·24H2O
4.在高温下,反应2HBr(g) ![]() H2(g)+Br2(g)(正反应是吸热反应)达到平衡时,要使混合气体颜色加深,可采取的方法是 ( )
H2(g)+Br2(g)(正反应是吸热反应)达到平衡时,要使混合气体颜色加深,可采取的方法是 ( )
A. 增加氢气浓度 B. 减小压强
C. 缩小体积 D. 降低温度
5.下列四种物质,只能与NaOH溶液作用,不能与盐酸作用的是 ( )
A. NaHS B. NaAlO2 C. KHSO4 D. CH3COONH4
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分;但只要选错一个,该小题就为0分。)
6.把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是 ( )
A. 自来水 B. 0.5 mol / L盐酸
C. 0.5 mol / L HAc溶液 D. 0.5 mol / L KCl溶液
7.下列块状金属在常温时能全部溶于足量浓HNO3的是 ( )
A.Ag B.Cu C.A1 D.Fe (MCE00.)
8.下列物质中,能用浓盐酸鉴别的组别是 ( )
A. 锌、铝、铜、铁
B. 氧化钠、碳酸钠、偏铝酸钠、硫酸钠
C. 炭黑、氧化铜、铁粉、硫化亚铁
D. 芒硝、碳铵、苏打、明矾
9.Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2 +2H2O ![]() Fe(OH)2+2H ,往该溶液中逐滴加入盐酸,发生的变化是 ( )
Fe(OH)2+2H ,往该溶液中逐滴加入盐酸,发生的变化是 ( )
A. 平衡向逆反应方向移动 B. 平衡向正反应方向移动
C. 溶液颜色由浅绿色变为黄色 D. 溶液颜色由浅绿色变为深绿色
10.下列离子方程式正确的是 ( )
A. 三氯化铁溶液中滴入氨水:Fe3 +3NH3·H2O=Fe(OH)3↓+3 ![]()
B. 苏打溶液中滴入少量稀盐酸: ![]() +2H =H2O+CO2↑
+2H =H2O+CO2↑
C. 漂白粉溶液中通入过量CO2:ClO-+CO2+H2O=HClO+ ![]()
D. 碳酸钡与稀硫酸反应:BaCO3+2H =Ba2 +CO2↑+H2O
11.下列说法正确的是 ( )
A. 氧化性:Cl2>I2>Fe3 B. 热稳定性:NaOH>Al(OH)3>AgOH
C. 熔点:生铁>纯铁>铝 D. 还原性: I->Br->S2-
12.把0.02 mol / L HAc溶液和0.01 mol / L NaOH溶液以等体积混合,则混合液中微粒浓度关系正确的为 99上海 ( )
A. C(Ac-)>C(Na ) B. C(HAc)>C(Ac-)
C. 2C(H )=C(Ac-)-C(HAc) D. C(HAc)+C(Ac-)=0.01 mol / L
13.某溶液中有 ![]() 、Mg2 、Fe2 和Al3 四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是(MCE96.18) ( )
、Mg2 、Fe2 和Al3 四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是(MCE96.18) ( )
A. ![]() B. Mg2 C. Fe2 D. Al3
B. Mg2 C. Fe2 D. Al3
三、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项符合题意。)
14.下列叙述不正确的是 ( )
A. 两种盐溶液反应不一定能生成两种新盐
B. 白磷(P4)、晶体硅的分子构型均为正四面体
C. 同种分子的性质不一定相同,同种元素的原子的性质也不一定完全相同
D. 碱性氧化物全是金属氧化物,酸性氧化物不一定是金属氧化物
15.将50 mL某未知浓度的AlCl3溶液分别加到60mL 1mol / L的NaOH溶液或60 mL 3mol / L的NaOH溶液中,均能得到1.56 g Al(OH)3沉淀。则此AlCl3溶液的浓度可能是( )
A. 1 mol / L B. 0.5 mol / L C. 0.6 mol / L D. 0.4 mol / L
16.下图是合成氨的简要流程示意图
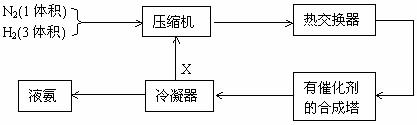
沿X路线回去的物质是 ( )
A. N2和H2 B. 催化剂 C. NH3 D. H2
17.已知工业上真空炼铷的化学方程式为:2RbCl+Mg ![]() MgCl2+2Rb(g), 对于此反应,能够进行正确解释的是 ( )
MgCl2+2Rb(g), 对于此反应,能够进行正确解释的是 ( )
A. Rb比Mg金属性强
B. Rb比Mg沸点低,当把铷蒸气抽走时,平衡向正反应方向移动
C. MgCl2对热的稳定性比RbCl的弱
D. 高温下,Mg2 得电子的能力比Rb 弱
18.已知[NH4Cl]≤0.1 mol/L时,溶液pH>5.1。现用0.1 mol/L盐酸滴定10 mL 0.05 mol/L氨水,用甲基橙作指示剂,达到滴定终点,所用盐酸的体积为 ( )
A. 10 mL B. 5 mL C. 大于5 mL D. 小于5 mL
19.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是 ( )
A. 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B. 同价态的阳离子,甲比乙的氧化性强
C. 甲能跟稀盐酸反应放出氢气而乙不能
D. 将甲、乙作电极组成原电池时,甲是正极
20.将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近于 ( )
A. 2×10-10 mol/L B. ![]() (10-8+10-10)mol/L
(10-8+10-10)mol/L
C. (10-8+10-10)mol/L D. (1×10-14-5×10-5)mol/L
21.在pH=1的无色透明溶液中不能大量共存的离子组是 ( )
A. Al3 、Ag 、 ![]() 、Cl- B. Mg2 、
、Cl- B. Mg2 、 ![]() 、
、 ![]() 、Cl-
、Cl-
C. Mg2 、K 、 ![]() 、Cl- D. Zn2 、Na 、
、Cl- D. Zn2 、Na 、 ![]() 、
、 ![]()
22.镁带在空气中燃烧生成的固体产物主要是氧化镁和氮化镁。将燃烧后的固体产物溶解在60 mL浓度为2.0 mol/L的盐酸溶液中(氮化镁和盐酸反应的化学方程式为:Mg3N2+8HCl=3MgCl2+2NH4Cl)以20 mL 0.5 mol/L的氢氧化钠溶液中和多余的盐酸,然后在此溶液中加入过量的碱,把氨全部蒸发出来,用稀盐酸吸收,稀盐酸增重0.17 g。镁带的质量为
( )
A. 0.6 g B. 1.2 g C. 2.4 g D. 3.6 g
四、(本题包括2小题,共19分)
23.(9分)已知 ![]() 在酸性条件下,发生还原反应后的产物为NO;发生氧化反应后的产物为
在酸性条件下,发生还原反应后的产物为NO;发生氧化反应后的产物为 ![]() 。现有稀H2SO4 、NaOH溶液、氨水、KMnO4溶液、KI淀粉溶液、NaNO2溶液等试剂。请用简捷、实验现象明显的方法来说明亚硝酸根既具有氧化性又有还原性。(已知MnO2在酸性条件下遇还原剂可转变成Mn2 )
。现有稀H2SO4 、NaOH溶液、氨水、KMnO4溶液、KI淀粉溶液、NaNO2溶液等试剂。请用简捷、实验现象明显的方法来说明亚硝酸根既具有氧化性又有还原性。(已知MnO2在酸性条件下遇还原剂可转变成Mn2 )
(1) 说明 ![]() 具有氧化性,应选用的试剂有___________________________;发生的现象是______________;反应的离子方程式为_____________________________________。
具有氧化性,应选用的试剂有___________________________;发生的现象是______________;反应的离子方程式为_____________________________________。
(2) 说明 ![]() 具有还原性,应选用的试剂有___________________________;发生的现象是______________;反应的离子方程式为_____________________________________。
具有还原性,应选用的试剂有___________________________;发生的现象是______________;反应的离子方程式为_____________________________________。
24.(10分)用高岭土(主要成分是Al2O3·SiO2·2H2O,并含少量CaO、Fe2O3)制新型净水剂(铝的化合物)。进行实验的步骤如下:
将土样和纯碱混匀,加热熔融,冷却后用水浸取熔炔,过滤,弃去残渣。滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即为净水剂。
(1) 写出熔融时,主要成分与纯碱反应的化学方程式(Al2O3与SiO2跟纯碱的反应相似)
A. _________________________________________________________________,
B. _________________________________________________________________。
(2) 最后的沉淀物是(写化学式)_________________,生成该沉淀的离子方程式是
___________________________________________________________。
(3) 实验室中常用的坩埚有瓷坩埚、氧化铝坩埚和铁坩埚,本实验在熔融土样时应选用________坩埚。
五、(本题包括5小题,共33分)
25.(10分)Fe3P与稀HNO3反应生成Fe(NO3)3、NO、H3PO4和H2O。
(1) 写出反应的化学方程式并配平:
___________________________________________________________________;
(2)上述反应中,当生成1.8 mol Fe3 时,放出NO的体积(标准状况下)是_________L,消耗的HNO3是__________mol;
(3) 上述反应中,当有21 mol电子发生转移时,生成H3PO4是_________mol, 被还原的HNO3是___________g。
26.(7分)某河道两旁有甲乙两厂。它们排放的工业废水中,共含K 、Ag 、Fe3 、C1-、OH- 、 ![]() 六种离子。 (99上海)
六种离子。 (99上海)
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子 、 、
。
乙厂的废水中含有另外三种离子。假如加一定量 (选填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金属 (填写金属元素符号)。
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
27.(6分)将等物质的量的A、B混合于两升的密闭容器中,发生下列反应:
3A(g)+B(g) ![]() xC(g)+2D(g)
xC(g)+2D(g)
经5 min后达到平衡时,测知D的浓度为0.5 mol / L,[A]∶[B]=3∶5,C的平均反应速率是0.1 mol / (L·min),A的平衡浓度为_____________,B的平均反应速率为_______________,x值是__________。
28.(6分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所
示的物质之间的变化:
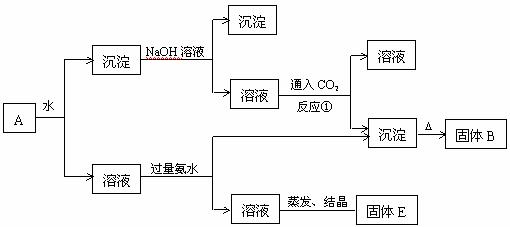
据此判定:
(1) 固体B所含物质的化学式 。
(2) 固体E所含物质的化学式 。
(3) 反应①的离子方程式为 。
29.(4分工业上从海水中提取金属镁的反应如下:
Ca(OH)2+Mg2 (海水中)=Mg(OH)2↓+Ca2
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2 ![]() Mg+Cl2↑
Mg+Cl2↑
在提取过程中,当氯化镁从溶液中析出时,得到的是MgCl2·6H2O,为制得无水氯化镁,工业上常将MgCl2·6H2O在HCl气氛中加热来制取。试解释其原因(用文字简要回答)
__________________________________________________________________________
_____________________________________________________________________。
六、计算题(本题包括2小题,共15分)
30.(6分)往100 mL溴化亚铁溶液中缓慢通入2.24 L(标准状况)氯气,反应完成后溶液中有 ![]() 的溴离子被氧化成溴单质。求原溴化亚铁溶液的物质的量浓度。
的溴离子被氧化成溴单质。求原溴化亚铁溶液的物质的量浓度。
(提示:2Fe2 +Br2=2Fe3 +2Br-,不考虑氯气与水的反应)
31.(9分)N2O4(g) ![]() 2NO2(g)(正反应为吸热反应),在1.01×105 Pa、47℃时,N2O4分解率为40%,在1.01×105 Pa、57℃时,N2O4分解率为50%。若在1.01×105 Pa、47℃时体积为2 L 的平衡混合物,保持压强不变,升温至57℃并达到平衡,则平衡混合气体的体积是多少升?
2NO2(g)(正反应为吸热反应),在1.01×105 Pa、47℃时,N2O4分解率为40%,在1.01×105 Pa、57℃时,N2O4分解率为50%。若在1.01×105 Pa、47℃时体积为2 L 的平衡混合物,保持压强不变,升温至57℃并达到平衡,则平衡混合气体的体积是多少升?
答 案
一、1. A 2. C 3. A 4. C 5.. C
二、6. B 7. AB 8. C 9. AC 10. AC 11. B 12. AD 13. AC
9. 解析:此题易漏选C。不知道反应产生HNO3,会氧化Fe2 为Fe3 。另外,有些学生搞不清溶液的颜色。
三、14. B 15. A 16. A 17. B 18. C 19. C 20. A 21. A 22. B
四、23. (1) NaNO2溶液、KI淀粉溶液、稀H2SO4;溶液变蓝; 4H +2 ![]() +2I- =I2+2NO↑+2H2O (2) NaNO2溶液、KMnO4溶液、稀H2SO4;溶液紫色褪去; 5
+2I- =I2+2NO↑+2H2O (2) NaNO2溶液、KMnO4溶液、稀H2SO4;溶液紫色褪去; 5 ![]() +2
+2 ![]() +6H =5
+6H =5 ![]() +2Mn2 +3H2O
+2Mn2 +3H2O
24. (1) Al2O3+Na2CO3 ![]() 2NaAlO2+CO2↑;SiO2+Na2CO3
2NaAlO2+CO2↑;SiO2+Na2CO3 ![]() Na2SiO3+CO2↑ (2) H2SiO3;
Na2SiO3+CO2↑ (2) H2SiO3; ![]() +2H =H2SiO3 (3) 铁
+2H =H2SiO3 (3) 铁
五、25. (1) 3Fe3P+41HNO3=9Fe(NO3)3+14NO↑+3H3PO4+16H2O (2) 62.72 L; 8.2 mol (3) 1.5 mol; 441 g
26. OH-;C1-;K ;铁粉;Ag(或银);Ag 、K 、Fe3 、C1-、OH-;KNO3
27. 0.75mol / L;0.05mol / (L·min);2
28. (1) Al2O3 (2) K2SO4、(NH4)2SO4 (3) 2 ![]() +2CO2+3H2O=2Al(OH)3¯+
+2CO2+3H2O=2Al(OH)3¯+ ![]()
29. 因为Mg2 能水解显弱酸性,加热时促进水解反应的进行,生成更多的Mg(OH)2,而且加热蒸干时,Mg(OH)2还会分解为MgO,从而得不到无水MgCl2。将MgCl2·6H2O在HCl气氛中加热,可抑制水解,防止副反应发生而得到无水氯化镁。
六、30.由提示知,还原性:Fe2 >Br-,Br-已部分被氧化,故Fe2 已全部被氧化。
设原FeBr2的物质的量浓度为x,根据氧化还原反应中,得电子总数等于失电子总数,可得:
(x+2x× ![]() )×0.1 L×1=2×
)×0.1 L×1=2× ![]()
x=1.2 mol·L-1
31. 设47℃时N2O4的体积为V1,57℃时N2O4的体积为V2
N2O4(g) ![]() 2NO2(g)
2NO2(g)
V0 (L) V1 0
V变(L) 0.4V1 0.8V1
V平(L) 0.6V1 + 0.8V1 = 1.4V1
1.4V1=2 L,V1=1.428 L
由 ![]() =
= ![]() ,得V2=
,得V2= ![]() =
= ![]() =1.474 L
=1.474 L
N2O4(g) ![]() 2NO2(g)
2NO2(g)
V0 (L) V2 0
V变(L) 0.5V2 V2
V平(L) 0.5V2 + V2 = 1.5V2
1.5V2=1.5×1.474 L=2.11 L
