本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题两部分),第Ⅰ卷的答案填在第Ⅱ卷前的答题栏内,第Ⅱ卷的答案直接填在试题卷上,考试时间90分钟,满分120分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Cu-64
第Ⅰ卷(选择题共54分)
一、选择题(每小题3分,共30分,每小题只有一个选项符合题意)
1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
2.第二次世界大战期间,某国侦察小分队到德国法西斯一座十分隐蔽且又戒备森严的军火厂,上级要求小分队在三天内必须炸毁它,结果他们用十多只涂有化学药剂的老鼠完成了任务。据你推测这种药剂是
A.黑火药和酒精 B.白磷和二硫化碳溶液
C.高锰酸钾和硫酸 D.硝酸铵和水
3.一种化学冰袋含有Na2SO4·10H2O(96g)、NH4NO3(50g)、(NH4)2SO4(40g)、NaHSO4(40g)将和其它三种盐分别放在二只塑料袋中,同时把它们混合并用手搓揉就可致冷,致冷效果能维持2-3小时。以下关于致冷原因的推测肯定错误的是
A.脱水是吸热过程
B.较长时间致冷是由于脱水过程较慢
C.铵盐在该条件下发生的是复分解反应会吸收热量
D.溶于结晶水中会吸收热量
4.室温下,浓度为0.1mol/L-1HA、HB、HC、HD四种一元酸,已知HA溶液中c(H )=0.1mol/L-1,电离常数K(HC)<K(HB)<K(HD)。四种酸对应的钠盐,在同温同浓度的条件下,从pH大到小的顺序为
A.NaA>NaB>NaC>NaD B.NaB>NaC>NaA>NaD
C.NaD>NaA>NaC>NaB D.NaC>NaB>NaD>NaA
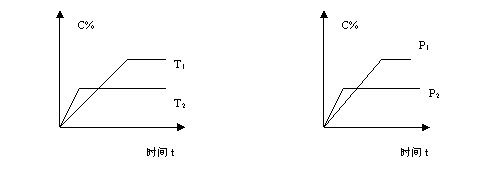
5.可逆反应:Ma(s) Nb(g) ![]() eC(g) fD(g),当其它条件不变时,C的百分含量C%与温
eC(g) fD(g),当其它条件不变时,C的百分含量C%与温
度(T)和压强(P)的关系如右图所示。下列叙述正确的是
A.T1<T2,正反应是吸热反应. B.P1<P2,n<e f
C.P1>P2,m n>e f D.达到平衡后,增加A的量有利于平衡向正反应方向移动。
SHAPE \* MERGEFORMAT
|
C%%% |
|
时间t |
|
T1 |
|
T2 |
|
C% |
|
时间t |
|
P2 |
|
P1 |
6.经X射线研究证实,PCl3在固态时由空间构型分别是正四面体和正八面体的两种离子构成。下列有关推断错误的是
A.PCl3固体是离子晶体
B.PCl3晶体没有导电性
C.PCl3由[PCl3]2 和[PCl7]2-构成,且离子个数之比为1:1
D.正四面体的离子是[PCl4] ,正八面体的离子是[PCl6]-
7.下列分子中原子的价电子全部参加成键的是
A.N2 B.NF3 C.PCl5 D.CH4
8.在NaH2PO4脱水形成聚磷酸盐Na180H2P180O541过程中,共脱去水分子的数目为
A.178 B.179 C.180 D.181
9.N2O(俗称笑气)是较早使用的一种麻醉剂。N2O的分子结构和CO2一样属于直线型,分子中每个原子的四周都有8个电子。下列有关N2O的说法不正确的是
A.该分子为非极性分子 B.分子中含非极性共价鍵
C.其结构式为NN→O D.其鍵角为180
10.为同时施用分别含有N、P、K三种元素的化肥,对于给定的化肥:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤氨水,最适宜的组合是
A.①③④ B.②③④ C.①③⑤ D.②③⑤
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分,若正确答案包括两个先项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题为0分)
11.下列各组离子在指定的环境下能大量共存的是
A.pH=1的溶液中:Na 、Fe2 、Cl-、NO3- B.pH=7的溶液中Na 、Al3 、NO3-、AlO2-
C.pH>7的溶液中Na 、K 、S2-、SO32- D.pH=8的溶液中K 、Na 、SO32-、NO3-
12有某种仪器量一液体的体积时,平视读数为nmL,仰视读数为xmL,俯视读数为ymL,若x>n>y,则所使用的仪器可能是
A.量筒 B.酸式滴定管 C.烧杯 D.容量瓶.
13.下列离子方程式正确的是
A.漂白粉溶液中通入过量的SO2:Ca2 SO2 H2O ClO-=CaSO3↓ 2HClO
B.铜溶于过量的稀硝酸3Cu 2NO3- 8H =3Cu2 2NO↑ 4H2O
C.铜溶于FeCl3溶液中Fe3 Cu=Fe2 Cu2
D.Fe3O4溶于盐酸:Fe3O4 8H =Fe2 2Fe3 4H2O
14.可逆反应:3A(g) ![]() 3B(g) C(?)-Q,随温度的升高,气体平均相对分子质量有变小的趋势,则下列判定正确的是
3B(g) C(?)-Q,随温度的升高,气体平均相对分子质量有变小的趋势,则下列判定正确的是
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定为气体 D.B和C可能都是气体
15.在25时,某氯化铵溶液的pH=4,下列说法中不正确的是
A.溶液中c(H )>c(OH-),且c(H )·c(OH-)=1×10-14
B.由水电离出来的H 浓度为1×10-4mol/L-1
C.溶液中c(Cl-)>c(NH4 )>c(H )>c(OH-)
D.此溶液中由水电离出来的c(H )>c(OH-)
16.有人建议用AG表示溶液的酸度(acidity grade),AG=lg{C(H )/C(OH-)},下列表述正确的是
A.若溶液呈中性,则pH=7,AG=0
B.若溶液呈酸性,则pH<7,AG<0
C.若溶液呈碱性,则pH>7,AG>0
D.在25时,溶液的pH与AG的换算公式为AG=2(7-pH)
第Ⅱ卷(非选择题共65分)
 |
三、(本题包括2小题,共有20分)
17.(10)如图所示,在一盛有500mL液体A的烧杯中
有一悬浮的小球(小球不与液体发生反应):
(1)若液体A是10mol/L-1的氨水,向烧杯中慢慢加入1mol氯
化镁固体,搅拌后静置,小球将 (选填“下沉”或
“上浮”)反应的离子方程式为
(2)若液体A是5mo/lL-1的硫酸铜溶液,向烧杯中慢慢加
入适量的铁粉,搅拌静置,小球将 (选填“下沉”
或“上浮”、“不变”),反应的离子方程式为
(3)若液体A是蒸馏水,向其中分若干次加入金属
钠共计15g,小球将 (选填“下沉”或“上浮”)反应后,溶液中由水电离的将(填“增大”、“减小”,理由是
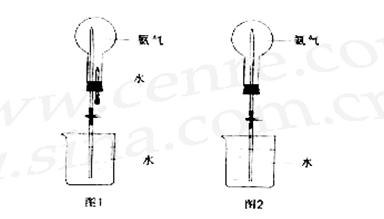
18.(10分)实验室要制取氨气并完成喷泉实验。
(1)写出实验室选用图Ⅰ装置来制取氨气,试剂有:①NH4Cl(s) 、②Ca(OH)2(s)、③NH4NO3(s)、④浓氨水、⑤氢氧化钠溶液、⑥CaO(s) 最合适的试剂是(填编号)
 | |||
 | |||
|
(2)收集氨气应使用法 ,要得到干燥的氨气可选用 做干燥剂。
(3)用上列图Ⅱ装置进行喷泉实验,上部烧瓶已装满氨气,引发水上喷的操作是 ,该实验的原理是 。
(4)假如只提供如图Ⅲ的装置,请说明引发喷泉的方法:
.
(5)假如图的装置有3个,烧瓶中分别盛有:①纯氨气、①含有1/10空气的氨气、③纯二氧化氮,在同温下分别进行喷泉实验,理论上得到的溶液物质的量浓度为
A.①=②=③. B.①>②>③ C.①>③>② D.②>①>③
四、(本题包括3小题,共32分)
19.(12分)如图所示,温度不变的某容器分隔成A、B两部分,A容积固定不变,B中有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2 O2 ![]() 2SO3
2SO3
根据下列要求填写空白:
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,O2为amol,B中压强为PB,O2为bmol,则PA PB,a b(选填>、<、=)
(2)若B中活塞移至5处,达到平衡时,B中SO3为xmol,A中SO3为ymol,则x y(选填>、<、=)理由是
(3)若B中活塞固定在5处,A中改充1molH2和1molI2(g),B中改充2molHI,在相同温度下反应达到平衡后,两容器中HI的物质的量 (填相等或不相等)两容器中颜色相比较 (填①A中深,②B中深,③一样深)
SHAPE \* MERGEFORMAT
|
反应容器 |
|
活塞 |
|
B |
|
A |
|
3 2 1 0 1 2 3 4 5 |


20.(10分)有的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种溶液的物质的量溶液依次为C1、C2、C3,则其关系是 (用>、<、=表示,下同)
(2)取同体积的三种酸分别加蒸馏水稀释到,需水的体积依次为V1、V2、V3,则其关系是
(3)完全中和体积和物质的量浓度均相同的溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为a1、a2、a3,则其关系是 ;瓜过程中放出的速率依次为b1、b2、b3,则其关系是 。
21.(10分)(1)将两朵紫色的鲜花,分别插入食用白醋的
稀溶液和碳酸钠(碱面)的稀溶液中(如图所示),由于叶
片和花蕊的蒸腾作用,溶液通过茎中的导管送到叶片和花蕊。
 天天更换上述稀溶液,几天后,你会发现食醋稀溶液中花的
天天更换上述稀溶液,几天后,你会发现食醋稀溶液中花的
颜色变成了 色,原因是
(请从化学原理角度简答);碳酸钠稀溶液中花的颜色变成
了 色,原因是 。
(2)配平下列氧化还原反应并适当填充
①□NH4NO3 ![]() □N2 □HNO3 □H2O
□N2 □HNO3 □H2O
在该反应中,电子转移的数目是
②□Cu2S □HNO3 ![]() □Cu(NO3)2 □NO↑ □H2SO4 □H2O
□Cu(NO3)2 □NO↑ □H2SO4 □H2O
在该反应中,被还原的硝酸与未被还原的硝酸物质的量之比为
五、(本题包括2小题,共14分)
22.(7分)A、B、C、D是中学化学中常见的单质,甲、乙、丙为化合物。已知甲具有磁性;乙在常温常压下为无色无味液体,既能与酸性氧化物反应,又能与碱性氧化物反应,但都不生成盐。它们之间存在如下图所示转化关系:
SHAPE \* MERGEFORMAT
|
丙 |
|
A 乙 |
|
B D |
|
加D |
|
加C |
|
一定条件 |
|
电解 |
|
△ |
|
A |
|
甲 |
|
甲 C |
|
加B |
|
加乙 |
|
高温 |
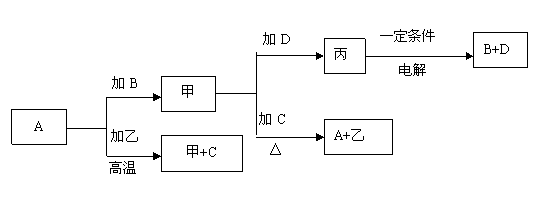

(1)元素A位于元素周期表中的 周期 族
(2)化合物乙的电子式为
(3)写出甲和D反应的化学方程式(注明条件)
(4)写出D和烧碱溶液反应的离子方程式(标明电子转移方向和数目
23.(7分)25.6mg铜与含有1.4×10-3mol的浓硝酸恰好完全反应,放出的气体用排四氯化碳液体的方法收集,其气体的体积在标准状况下为多少mL?(不考虑生成N2O4)。将收集到的气体倒立于水槽中,向其中通入标准状况下的O2多少。才能使气体全部生成硝酸?
孝感市高二化学参考答案
一、二题:
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
选项
A
B
C
D
B
C
D
B
A
B
CD
B
BD
CD
D
AD
三、17.(10分)(1)上浮(1分)Mg2 2NH3H2O=Mg(OH)2↓ 2NH4 (2分)
(2)下沉(1分)Cu2 Fe=Cu Fe2 (2分)
(3)上浮(1分)增大(1分)蒸馏水中存在电离平衡H2O=H OH-,加入金属钠,钠与H 反应放出H2,使水的电离平衡向右移动,故由水电离出来的H 和OH-离子浓度增大。(2分)
18.(10分)(1)和(2分)(2)向下排空气(1分)碱石灰(1分)
(3)打开止水夹,挤出胶头滴管中的水(1分)氨气极易溶解于水,致使烧瓶内气体的压强迅速减小(1分)
(4)打开止水夹,用手(或热毛巾)将烧瓶捂热,氨气受热膨胀,赶出玻璃管内的空气,氨气与接触,即发生喷泉(2分)其它合理答案同样给分
(5)A(2分)
19.(2分)(1)<(2分)=(2分)
(2)<(2)分活塞由3移到5处,B中的平衡向气体物质的量增大的方向移动(或逆反应方向移动)(2分)
(3)相等(2分)(2分)
20.(10分)每空2分(1)C2<C1<C3或C3>C1>C2;(2)V1=V2<V3;(3)V1=V2>V3;(4)a1=a2=a3 b1=b2<b3
四、21.(10分)(1)红(1分)花蕊在酸性条件下呈红色(1分)蓝(1分)碳酸钠水解呈碱性,花蕊在碱性条件下呈蓝色(1分)
(2)①5NH4NO3 ![]() 4N2 2HNO3 9H2O(2分)15e(1分)
4N2 2HNO3 9H2O(2分)15e(1分)
②3Cu2S 22HNO3 ![]() 6Cu(NO3)2 10NO↑ 3H2SO4 11H2O(2分)5:6(1分)
6Cu(NO3)2 10NO↑ 3H2SO4 11H2O(2分)5:6(1分)
22.(7分)(1)四面期;Ⅷ(1分)(2)(略)(1分)
(3)(2分)3Fe3O4 8Al=4Al2O3 9Fe
(4)(3分)2Al 6H2O 2OH-=2AlO2- 3H2↑ 4H2O
五、23.(7分)n(Cu)=25.6mg/64g/mol=0.4mmol
放出的气体既有,又有,根据氮原子守恒,有
n(混)=n(NO) N(NO2)=N(HNO3)-2n[Cu(NO3)2]=n(HNO3)-2n(Cu)
1.4mmol-2*0.4mmol=0.6mmol
标况下气体的体积为22.4L/mol*0.6mmol=13.44mL
又根据电子得失守恒,有:2n(Cu)=4n(O2)
n(O2)=1/2n(Cu)=1/2*0.4mmol=0.2mmol
通入标况下O2的体积为22.4L/mol*0.2mmol=4.48ml
答:(略)(其它合理解法同样给分)
