|
化 学
(时间:90分钟 满分100分) 2008年11月
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至3页,第Ⅱ卷4至5页。
第Ⅰ卷(选择题,共48分)
(本题包括16小题,每小题3分,共48分。每小题有一个选项符合题意。)
1. 空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是( )
A. 推广使用燃煤脱硫技术,防治SO2污染
B. 实施绿化工程,防治扬尘污染
C. 研制开发燃料电池汽车,消除机动车尾气污染
D. 加大石油、煤炭的开采速度,增加化石燃料的供给量
2. 下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 反应物和生成物各自具有的总能量决定反应是放热还是吸热
C. 任何放热反应在常温条件下一定能发生
D. 钠和氧气反应生成氧化钠后,生成物能量明显升高
3. 含Ba(OH)2lmol的稀溶液与足量稀盐酸反应,放出114.6kJ的热量,表示该反应中和热的热化学方程式正确的是 ( )
A. Ba(OH)2(aq) 2HCl(aq)=BaCl2(aq) 2H2O(l);ΔH = -114.6kJ/mol
B.Ba(OH)2(aq) 2HCl(aq)=BaCl2(aq) 2H2O(l);ΔH = 114.6kJ/mol
C.1/2Ba(OH)2(aq) HCl(aq)=1/2BaCl2(aq) H2O(l);ΔH = -57.3kJ/mol
D.1/2Ba(OH)2(aq) HCl(aq)=1/2BaCl2(aq) H2O(l);ΔH = 57.3kJ/mol
4.下列说法或表示法正确的是( )
A.等质量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石)ΔH=+1.19 kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)= 2H2O(l);ΔH=-285.8 kJ/mol
5.(1)已知胆矾失水的化学反应方程式为:CuSO4·5H2O(s)=CuSO4(s) 5H2O(l);△H= Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:CuSO4(s)=Cu2 (aq) SO42-(aq);△H=-Q2kJ/mol
(3)胆矾溶于水时,溶液温度降低。Q1与Q2的关系是(Q1、Q2为正数)
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
6.只改变反应容器的体积不会使下列化学平衡发生移动的是
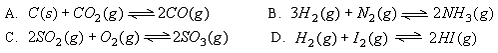
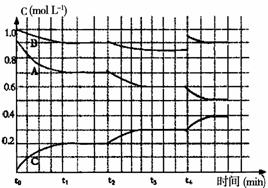
7. 在一定温度下体积固定的容器中,可以充分说明可逆反应A(g) 3B(g)  3C(g) D(g),达到平衡状态的是( )。 3C(g) D(g),达到平衡状态的是( )。
A.器内压强不随时间变化而变化
B.反应器内A、B、C、D物质的量比为1:3:3:1
C.生成A的速率和生成的D的速率相等
D.生成 1mol A同时有3 mol C被消耗
8. 用铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加大的是( )。
A.加水 B.不用稀硫酸,改用98%浓硫酸
C.加少量CH3COONa固体 D.不用铁片,改用铁粉
9. 下列说法正确的是( )。
A.非自发进行的的反应一定不能发生 B.自发进行的反应一定能发生
C.在一定条件下,非自发进行的反应也能发生 D.吸热反应一定不能自发进行
10. 可逆反应3A(g) 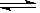 3B(?) C(?);△H>0,随着温度的升高,气体平均相对分子质量有变小趋势,则下列判定中正确的是( )。 3B(?) C(?);△H>0,随着温度的升高,气体平均相对分子质量有变小趋势,则下列判定中正确的是( )。
A.B和C可能都是固体 B.B和C可能都是气体
C.若C为固体,则B不一定是气体 D.B和C肯定都是气体
11. 某温度下,密闭容器中发生反应aX(g) 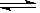 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )。 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )。
A. 可逆反应的化学计量数数:a>b+c
B.压缩容器的容积时,v正增大,v逆减小
C.达到新平衡时,混合物中Z的质量分数增大
D.达到新平衡时,物质X的转化率减小
12.已知:4NH3(g) 5O2(g)==4NO(g) 6H2O(g),△H=-1025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )。 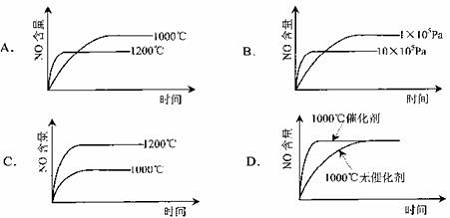
13. 在一定温度下发生反应:I2(g) H2(g)  2HI(g);并达平衡。HI的体积分数V(HI)随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下的变化如曲线(I)所示。在乙条件下V(HI)的变化如曲线(III)所示。则甲条件、乙条件分别是( )。 2HI(g);并达平衡。HI的体积分数V(HI)随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下的变化如曲线(I)所示。在乙条件下V(HI)的变化如曲线(III)所示。则甲条件、乙条件分别是( )。
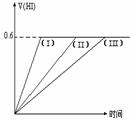 ① 恒容条件下,升高温度 ② 恒容条件下,降低温度 ③ 恒温条件下,缩小反应容器体积④ 恒温条件下,扩大反应容器体积⑤ 恒温恒容条件下,加入适当的催化剂 ① 恒容条件下,升高温度 ② 恒容条件下,降低温度 ③ 恒温条件下,缩小反应容器体积④ 恒温条件下,扩大反应容器体积⑤ 恒温恒容条件下,加入适当的催化剂
A.①⑤,③
B.②⑤,④
C.③⑤,②
D.③⑤,④
14. 已知可逆反应aA+bB  cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( ) cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( ) 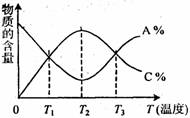 。 。
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到化学平衡
C.升高温度,平衡会向正反应方向移动
D.该反应的正反应是吸热反应过
15.在一个容积为6L的密闭容器中,放入3LX(g)和2LY(g),在一定条件下发生下列反应:4X(g) 3Y(g) 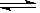 2Q(g) nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是( )。 2Q(g) nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是( )。
A.6 B.5 C.4 D.3
16. 在某温度下,反应 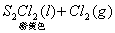 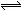 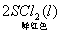 ;ΔH=-5016 kJ/mol,在密闭容器中达到平衡,下列说法错误的是( )。 ;ΔH=-5016 kJ/mol,在密闭容器中达到平衡,下列说法错误的是( )。
A.温度不变,增大容器的体积,液体的颜色变浅
B.温度不变,减少容器的体积, 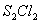 的转化率降低 的转化率降低
C.压强不变,升高温度,液体的颜色变浅
D.体积不变,降低温度,氯气的转化率升高
第II卷(非选择题,共52分)
17.(4分)在101kPa时,一定量的CO在1.00mol O2中完全燃烧,生成2.00molCO2,放出566.0kJ热量,CO的燃烧热为△H=__________________,表示CO燃烧热的热化学方程式为:______________________________________________________。
18.(8分)(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式 。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g) 1/2O2(g)==H2O(l)的△H=___________ kJ/mol。
(2) 0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式是__________________。
又知:H2O(l)==H2O(g);△H= 44 kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_______________kJ。
19. (14分)在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g) B(g) 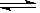 xC(g) 2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白: xC(g) 2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于
(2)A的转化率为
(3)生成D的反应速率为
(4)假如增大反应体系的压强,则平衡何体系中C的质量分数 (填“增大”、“减小”、或“不变”)
(5)在此温度下,该化学反应的平衡常数为___________________________
(6)假如上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol
20. (10分)在一个固定体积的密闭容器中,保持一定温度进行以下反应:
Br2(g) H2(g) 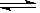 2HBr(g),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号 = 1 \* GB3 ①~ = 3 \* GB3 ③的状态,填写表中的空白: 2HBr(g),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号 = 1 \* GB3 ①~ = 3 \* GB3 ③的状态,填写表中的空白: |
已知
编号 |
起始状态的物质的量n/mol |
平衡时HBr的物质的量n/mol | |
H2 |
Br2 |
HBr |
| |
1 |
2 |
0 |
a | |
= 1 \* GB3 ① |
2 |
4 |
0 |
| |
= 2 \* GB3 ② |
|
|
1 |
0.5a | |
= 3 \* GB3 ③ |
m |
|
g(g≥2m) |
| | ![]() O2(g)==H2O(g);△H=-241.8kJ/mol -285.8
O2(g)==H2O(g);△H=-241.8kJ/mol -285.8