| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
根据以上数据,下列叙述正确的是 A.在上述条件下反应生成 lmolSO3 固体放热 Q/2 kJ B.2Q1 <2Q2=Q1<Q C.Ql =2 Q2= 2Q3 = Q D.2Q2 = 2Q3 < Q1 < Q 11.用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞用指示剂),下列有关实验的说法正确的是() A.向混有BaCO3沉淀的NaOH溶液中滴入盐酸,不会影响NaOH含量的测定 B.滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则不会影响计算结 C.若用甲基橙作指示剂,则测定结果偏小 D.可以不用将Na2CO3完全变成BaCO3沉淀,直接滴加标准盐酸,至不再有气泡产生
12.高铁酸钾 是一种新型、高效、多功能水处理剂,是比Cl2、O3、 ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。 湿法制备的主要反应方程为:2Fe(OH)3 3ClO - 4OH- =2FeO42- 3Cl- 5H2O , 干法制备的主要反应方程为:2FeSO4 6Na2O2 = 2Na2FeO4 2Na2O 2Na2SO4 O2↑ 下列有关说法不正确的是: A.高铁酸钾中铁显 6价 B.湿法中每生成1mol Na2FeO4 转移3mol电子 C.干法中每生成1mol Na2FeO4 转移4mol电子 D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 13.下列反应的离子方程式书写正确的是
B.电解硫酸铜溶液 2Cu2 2H2O C.SO2通入KMnO4溶液 SO2 MnO4- H2O = SO42- 2H Mn2 D. 硫酸氢钠溶液中加入氢氧化钡至溶液显中性:
14.如图所示,两个半球拼成的球形容器,内部被抽成真空,球形容器半径为R,大气压强为P,要使两半球分开两侧拉力至少为: A. 15.在双缝干涉实验中,以白光为光源,在屏幕上观察到了彩色干涉条纹。若在双缝的一缝前放一红色滤光片(只能透过红光),另一缝前放一绿色滤光片(只能透过绿光),这时( ) A.只有红色和绿色的双缝干涉,其他颜色的双缝干涉纹消失 B.任何颜色的双缝干涉条纹都不存在,但屏上仍有光亮 C.红色和绿色的双缝干涉条纹消失,其他颜色的双缝干涉条纹依然存在 D.屏上无任何光亮 16.瑞典皇家科学院2002年10月8日公布,将2002年诺贝尔物理学奖授予美国科学家戴维斯、贾科尼和日本科学家小柴昌俊,以表彰他们在天体物理学领域中的贡献。该奖表彰了两项成果,一项是在探测宇宙中微子方面取得的成就,另一项是发现了宇宙X射线源,这两方面的成就导致了中微子天文学、X射线天文学的诞生。你知道X射线产生的物理原理是( )。 A.原子中自由电子的运动产生 B.原子的外层电子跃迁产生 C.原子的内层电子受到激发后产生 D.处于激发态的原子核跃迁产生 17.下表记录了某受迫振动的振幅随驱动力频率变化关系,若该系统固有频率为
| 驱动力频率/Hz
| 30
| 40
| 50
| 60
| 70
| 80
| 受迫振动振幅/cm
| 10.2
| 16.8
| 27.2
| 28.1
| 16.5
| 8.3 |
A. ![]() =60Hz B.60Hz<
=60Hz B.60Hz< ![]() <70Hz
<70Hz
C.50Hz< ![]() <60Hz D.以上三个答案都不对
<60Hz D.以上三个答案都不对
18.雨滴自屋檐静止滴下,每隔0.2秒滴下一滴,第一滴落下时第六滴恰欲滴下,此时第一滴、第二滴、第三滴、第四滴之间的距离依次为1.62m、1.26m、0.90m,设落下的雨滴的运动情况完全相同,则此时第二滴雨滴下落的速度为:( )
A.8.00m/s B.7.84m/s C.7.20m/s D.7.00m/s
19.一个带电小球从空中的a点运动到b点的过程中,重力做功3J,电场力做功1J,克服空气阻力做功0.5J,则小球( )
①在a点的重力势能比在b点大3J ②在a点的电势能比在b点小1J
③在a点的动能比在b点小3.5J ④在a点的机械能比在b点大0.5J
A.①②正确 B.①③正确 C.②④正确 D.③④正确
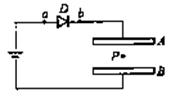 20.如图D是一个二极管,它的作用是只答应电流从a流向b,不答应电流从b流向a。平行板电容器AB内部的带电体P处于静止状态。下列关于因极板A的移动而引起的带电体P的运动情况的说法中正确的是:( )
20.如图D是一个二极管,它的作用是只答应电流从a流向b,不答应电流从b流向a。平行板电容器AB内部的带电体P处于静止状态。下列关于因极板A的移动而引起的带电体P的运动情况的说法中正确的是:( )
A.A板稍向上平移,P向上移动
B.A板稍向下平移,P向下移动
C.B板稍向上平移,P向上移动
D.B板稍向上平移,P向下移动
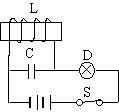 21.如图所示的电路中,L是自感系数很大的、用铜导线绕成的线圈,其电阻可以忽略不计,开关S原来是闭合的,当开关S断开瞬间,则( )
21.如图所示的电路中,L是自感系数很大的、用铜导线绕成的线圈,其电阻可以忽略不计,开关S原来是闭合的,当开关S断开瞬间,则( )
① L中的电流方向不变
② 灯泡D要过一会儿才熄灭
③ LC电路将产生电磁振荡,刚断开瞬间,磁场能最大
④ 电容器将放电,电场能将变为磁场能
A.①④ B.②③ C.①③ D.①②③

|
班级________________________姓名_____________________________准考证号______________________________________ |

 2009年普通高等学校招生全国统一考试(南开中学模拟卷)
2009年普通高等学校招生全国统一考试(南开中学模拟卷)
理科综合能力测试(八)
第Ⅱ卷
(共10题共174分)
注重事项:
1.答卷前将密封线内的项目填写清楚。
2.用钢笔或圆珠笔直接答在试卷上。
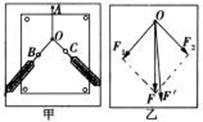 22.(18分) ⑴在“验证力的平行四边形定则”的实验中某同学的实验情况如图甲所示,其中A为固定橡皮筋的图钉,O为橡皮筋与细绳的结点,OB和OC为细绳。图乙是在白纸上根据实验结果画出的图。
22.(18分) ⑴在“验证力的平行四边形定则”的实验中某同学的实验情况如图甲所示,其中A为固定橡皮筋的图钉,O为橡皮筋与细绳的结点,OB和OC为细绳。图乙是在白纸上根据实验结果画出的图。
①图乙中的____________是力F1和F2的合力的理论值; ___________是力F1和F2的合力的实际测量值。
②在实验中,假如将细绳也换成橡皮筋,那么实验结果是否会发生变化?
答:_____________________________。(选填“变”或“不变”)
|
h |
|
B |
|
A |
|
C |
|
D |
|
R |
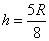
25.(24分)如图所示,两根质量均为2 kg的金属棒ab、cd静止放在光滑的水平导轨上,左、右两部分导轨间距之比为1:2,导轨间有强度相等、方向相反的匀强磁场,两棒的电阻之比Rab∶Rcd=1:2,导轨足够长且电阻忽略不计。若用250 N的水平力向右拉cd棒,在cd棒开始运动0.5m的过程中,cd棒上产生的焦耳热为30 J,cd棒运动0.5m后立即撤去拉力,这时两棒速度大小之比vab:vcd=1:2,求:
 (1)撤去外力时两棒的速度是多大?
(1)撤去外力时两棒的速度是多大?
(2)电路中产生的总的焦耳热是多少?
26.(一)(8分)X、Y、Z为三种短周期元素,核电荷数依次增大,且X、Y、Z三种元素的原子核外电子层数之和为5。已知X是原子结构最简单的元素,Y元素原子最外电子层上的电子数是其电子层数的2倍,Z元素是植物生长的重要营养元素。请回答下列问题:
(1)推断X、Y、Z的元素:X ,Y ,Z 。
(2)Y元素的单质中有一种称为足球烯的分子Y60,它可能最易发生的反应是 。
A.消去反应 B.取代反应 C.加成反应 D.聚合反应
(3)最近科学家们合成了Zn 5,电子式为 ![]() 则n值为 。
则n值为 。
(4)Z与X可形成多种化合物,其中ZX3的结构式为 ,Z2X4的电子式为
。(用判定出的元素符号表示)
(二)(8分)气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数。A在足量氧气中燃烧生成两种物质。B、D、E是中学化学中常见的气体。各物质有如图所示的转化关系:
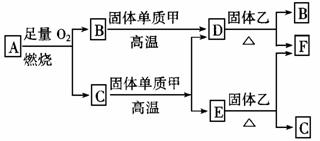
回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)______。
(2)若气体A为单一气体,且分子是直线型结构。又知X与Y两元素的质量比数值上等 于X的相对原子质量。A分子的电子式为__________。
(3)C与固体单质甲在高温下发生反应的化学方程_________________________。固体乙为常见化合物,写出一种固体乙的化学式____________________。
27.(18分) 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证实原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证实原固体粉末是 ,写出发生反应的离子方程式
。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuS04 . 5H20) °经查阅资料得知 ,
在溶液中通过调节溶液的酸碱性而使Cu2 、Fe2 、Fe3 分别生成沉淀的pH 如下:
物质
Cu(OH)2
Fe(OH)2
Fe(OH)3
开始沉淀pH
6.0
7.5
1.4
沉淀完全pH
13
14
3.7
实验室有下列试剂可供选择:A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3
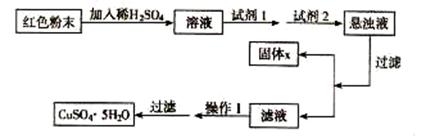 |
试回答:
① 试剂 = 1 \* ROMAN I为 ,试剂 = 2 \* ROMAN II为 (填字母)。
② 固体X的化学式为 。
= 3 \* GB3 ③ 操作 = 1 \* ROMAN I为 。
28.(18分)2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。

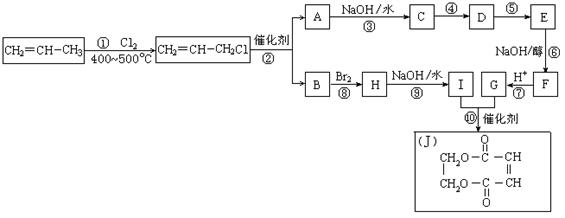 |
请按要求填空:
(1)写出下列反应的反应类型:
①______________,⑥______________,⑧______________。
(2)反应②的化学方程式是___________________________________________
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是__________________________________________物质E的结构简式是_______________________。
(4)反应⑩的化学方程式是__________________________________________
29.(14分)在元素周期表中处于相邻位置的元素在结构和性质上有许多相似的地方。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等,与之相似的氮元素的氢化物除NH3外,还有N2H4等。
⑴碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为
⑵该系列中的N2H4是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大并没有污染。已知4gN2H4在上述反应中放出71kJ的热量,写出该反应的热化学方程式
⑶该系列物中NH3对农业、化学、国防工业具有重要意义。其合成原理为:
N2(g) 3H2(g) ![]() 2NH3(g),DH= - 92kJ/mol。
2NH3(g),DH= - 92kJ/mol。
I.在一定温度下,将1.5molN2和6molH2通入到一个固定容积的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,此时反应放出的热量为
II.保持温度不变,在相同的容器中,将起始时的物质的量改为a mol N2、b molH2、c mol NH3,使平衡时NH3的物质的量分数为25%,则:
= 1 \* GB3 ①达到平衡时,I和II放出的热量 (填字母代号)
A.一定相等 B.前者一定小于后者
C.前者等于或小于后者 D.前者等于或大于后者
= 2 \* GB3 ②欲使开始时反应正向进行,a的取值范围为
30.(一)(7分)下表是对某水生生态系统营养级和能量流动情况的调查结果,表中A、B、C、D分别表示不同营养级生物,E为分解者。Pg表示生物同化作用固定能量的总量,Pn表示生物体内未被呼吸消耗的能量(Pn=Pg-R),R表示生物呼吸消耗的能量。(单位:102kJ/m2/年)请根据表中数据回答下列问题:
Pg
Pn
R
A
15.9
2.8
13.1
B
870.7
369.4
501.3
C
0.9
0.3
0.6
D
141.0
61.9
79.1
E
211.5
(1)此生态系统中能量流动是从表中的_________生物开始的,做出此判定的依据是
_______________________________________________________________。
(2)能量从第Ⅱ营养级传递到第Ⅲ营养级的效率是____________(保留一位小数)。
(3)从能量输出和输入角度看,该生态系统的总能量将会__________(增加、减少)。其原因是______________________________________________________。
(4)在测定此生态系统中鲢鱼的种群密度时,研究人员选择了40m×20m的区域,放置了40个捕鱼器,两次在相同时间段内捕捉的鲢鱼数量如下:
捕捉鲢鱼数量
被标记的鲢鱼数量
第一次
55
55
第二次
53
5
此生态系统中鲢鱼的总数量是_________尾,鲢鱼的种群密度是___________。
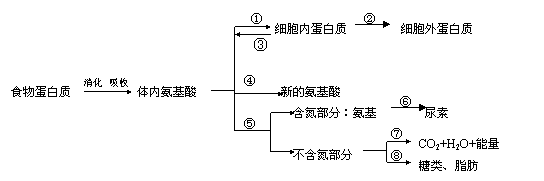
(二) ![]() 下图是高等动物和人体内蛋白质代谢过程示意图(图中数字序号表示有关代谢过程)
下图是高等动物和人体内蛋白质代谢过程示意图(图中数字序号表示有关代谢过程)
(8分)
|
细胞内蛋白质 细胞外蛋白质 食物蛋白质 体内氨基酸 新的氨基酸 含氮部分:氨基 尿素 不含氮部分 |
|
= 4 \* GB3 ④ = 6 \* GB3 ⑥ = 5 \* GB3 ⑤ |
|
= 7 \* GB3 ⑦ = 8 \* GB3 ⑧ |
|
消化 吸收 |
|
② = 2 \* GB3 ② |
|
CO2 H2O 能量 糖类、脂肪 |
|
= 1 \* GB3 ① = 2 \* GB3 ② |
|
③ |
 |
据图并结合你已有的生物学知识回答有关问题:
(1)动物冬眠后期形体消瘦,与此有关的蛋白质代谢过程主要是(填图中序号) 。
(2) 与 = 1 \* GB3 ①、 = 2 \* GB3 ②过程直接相关的细胞器依次: 。通过 = 2 \* GB3 ②过程到细胞外的蛋白质也有许多重要生理功能,如(答出两种功能蛋白质的名称和生理作用): = 1 \* GB3 ① ; = 2 \* GB3 ② 。
(3)肥胖者尽管不食油腻食物,仍然肥胖,与蛋白质代谢相关的可能原因
是: 。
(4) = 4 \* GB3 ④过程可称为 ,仅通过该过程产生的大量氨基酸仍满足不了人体自身蛋白质合成的需要,主要原因是 。
(5)在实验动物小肠末的肠腔中提取内容物,经检测一般不含游离氨基酸。由此可见,小肠吸收氨基酸的方式是 。
31㈠(7分)家蚕的性别由ZW型性染色体决定,其方式与XY型刚好相反,即雌性个体的体细胞含2个异型的性染色体,用ZW表示。
家蚕中存在肤色正常(Os)和油纸样透明皮肤(os)(其他各项生命活动指标均正常)两个品种,控制该相对性状的基因均位于Z染色体上,W染色体无相应等位基因。雄蚕吃的桑叶少,蚕丝产量高,质量好。
现有正常肤色和油蚕两个品种的雌、雄尚未交配的纯种蚕蛾若干,请你以遗传图解的方式设计一种杂交方案,目的是在幼龄阶段就能区分雌、雄个体,以便分别喂养和缫丝,提高蚕丝的产量和质量。
答:
㈡赤霉素是一种重要的植物激素,其主要作用是调节植物生长。(14分)
I.已知豌豆矮蔓植株的形成与缺少赤霉素有关。没有赤霉素就不能刺激茎蔓伸长,假如用赤霉素处理,矮生植株也可以长得和高蔓植株一样高,矮株没有赤霉素是因为缺少了合成赤霉素的一种要害酶。
(1)高蔓植株合成此种酶要经过“翻译”的过程,进行“翻译”的条件除核糖体外还需要有__________________________________________________________;
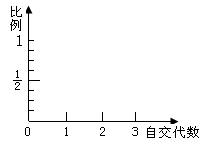
(2)假如形成矮生植株的原因是由于编码合成赤霉素的酶的基因发生了隐性突变,假如让基因型为Aa的植株自交,其后代再分别自交,这样自交三代,请在坐标轴上绘出自交后代中能稳定遗传的非矮化个体所占的比例与自交代数的数量变化关系的直方图,并将比例值注明在直方图的上方:
Ⅱ.玉米矮化病毒能显著抑制玉米植株的生长,因而感染这种病毒的玉米植株非常矮小。推测病毒的作用可能是抑制了赤霉素的合成。请用被矮化病毒感染的玉米幼苗、适宜浓度的赤霉素溶液、刻度尺、喷壶等设计实验来验证这一假设。
(1)实验步骤:
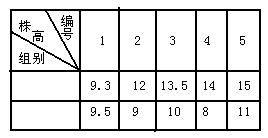 (2)右表是某生物小组所做实验的结果记录:
(2)右表是某生物小组所做实验的结果记录:
根据以上实验结果得出的实验结论是:
 2009年普通高等学校招生全国统一考试(南开中学模拟卷)
2009年普通高等学校招生全国统一考试(南开中学模拟卷)
理科综合能力测试(八)参考答案
第Ⅰ卷
题号
1
2
3
4
5
6
7
8
9
10
11
答案
D
C
C
B
C
C
B
B
B
D
A
题号
12
13
14
15
16
17
18
19
20
21
答案
C
B
C
B
C
C
C
B
C
C
|
A |
|
V |
|
Rx |
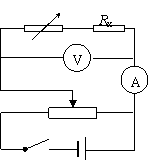 第Ⅱ卷
第Ⅱ卷
22.(1)①F (1分) F′(1分) ②不变 (2分)
(2)①如图 (4分)
②BDFH (2分)
③ ![]() (3分)
(3分)
U为电压表的读数,I为电流表的读数,R为电阻箱的读数。(1分)
⑶ ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() (2分)
(2分) ![]() (
( ![]() )(2分)
)(2分)
23.解析:(1)根据左手定则可确定a端电势高
(2)当导体内由于载流子有沿电流方向所在的直线定向分运动时,受洛伦兹力作用而产生横向分运动,产生横向电场,横向电场的电场力与洛伦兹力平衡时,导体横向电压稳定,设载流子沿电流方向所在直线定向移动的速率为v,横向电压为Uab,横向电场强度为E,电场力
FE=Ee= ![]() =
= ![]()
洛仑兹力 FB=evB
平衡时 FE=FB
得v= ![]() m/s=6.7×10-4 m/s
m/s=6.7×10-4 m/s
24.⑴因为A车恰能超过圆轨道最高点C,设速度为vc ![]()
![]()
A车被弹出的速度为vA ,由 ![]() 所以
所以 ![]()
![]()
⑵以A、B组成的系统为对象,设两车滑至D点处速度为 ![]() ,
,
由 ![]() ,向右为正方向
,向右为正方向 ![]()
![]()
由 ![]() ,
, ![]()
![]()
⑶由 ![]()
![]()
![]()
25.解析:⑴cd棒运动0.5m的过程中,由功能关系有:
![]()
由, ![]() ,
, ![]() 得:
得: ![]()
当 ![]() 时;
时; ![]() ,故
,故 ![]()
又 ![]()
所以 ![]()
又 ![]() ,所以撤去外力时:
,所以撤去外力时:
![]() ,
, ![]()
⑵由公式F=BIL知,任一时刻都有2Fab=Fcd,则 ![]()
由动量定律得 ![]() ,
, ![]()
稳定时 ![]() ,且2Lab=Lcd
,且2Lab=Lcd
联立解得:v’ab=6.4 m/s,v’cd=3.2 m/s
所以电路中产生的总的焦耳热为: ![]()
26(一)(共8分)(1)氢 碳 氮(写元素符号也可,每个1分,共3分)
(2)C (1分) (3)1(2分)
错误!嵌入对象无效。
(二)(8分)(1)H2(2)错误!嵌入对象无效。(3)H2O C ![]() CO H2 CuO(各2分)
CO H2 CuO(各2分)
27. (1)溶液变为血红色(2分)
(2)不合理 Cu能将Fe3 还原为Fe2 (2分)
(3)Fe2O3和Cu2O的混合物 Fe2O3 6H = 2Fe3 3H2O Cu2O 2H = Cu Cu2 H2O
2 Fe3 Cu = 2 Fe2 Cu2 (8分)
(4) ![]() (2分)
(2分)
(5) = 1 \* GB3 ① B D = 2 \* GB3 ② Fe(OH)3 = 3 \* GB3 ③加热蒸发(4分)
28.(18分)(1) 取代反应 消去反应 加成反应 (3分)
(2) ![]() 3分)
3分)
(3) ④ (3分)
保护A分子中C=C不被氧化 (3分) 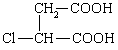 (3分)
(3分)
(4) 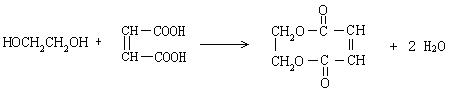 (3分)
(3分)
29.(14分)(1)NxH2 x (x³1且x为正整数) (2分)
(2)2N2H4(l) N2O4(l) = 3N2(g) 4H2O(g);DH= - 1136kJ/mol (3分)
(3)I、69kJ;II、D;0.75<a£1.5 (各3分)
30.(一)(7分)
(1)B(1分) B营养级生物含有的能量最多,是生产者,生态系统中能量流动是从生产者开始的(1分)
(2)11.3% (1分)
(3)增加(1分) 该生态系统输入的总能量大于所有生物消耗能量之和(Pg>R)(1分)
(4) 583(1分) 0.73/m2 (1分)
(二)(8分,每空1分)
(1) = 3 \* GB3 ③ = 5 \* GB3 ⑤ = 7 \* GB3 ⑦(说明:增答 = 6 \* GB3 ⑥ = 8 \* GB3 ⑧不扣分)
(2)核糖体、内质网、高尔基体; = 1 \* GB3 ①抗体,具有免疫作用; = 2 \* GB3 ②激素,具有调节作用(其它合理答案也给分)
(3)蛋白质摄取过多,转化为脂肪
(4)氨基转换作用;产生的氨基酸是非必需氨基酸(或人体必需氨基酸只能从食物获得)
(5)主动运输
31 (一)(7分)幼龄蚕中凡油纸样透明皮肤的均为雌蚕,肤色正常的蚕(携带者)均为雄蚕。
P 油蚕♂ 正常蚕♀
ZosZos × Z0sW
![]()
F1 Z0sZos ZosW
携带者♂ 油蚕♀
(二)(共14分).
I. (1)(4分,答对一项给1分,满分4分,含有错误答案不给分)信使RNA、转运RNA、氨基酸、酶、能量等
(2)(2分)
Ⅱ.(8分,每步2分,实验结论2分)
实验步骤:
第一步:选取长势基本相同的被矮化病毒感染的玉米幼苗若干株,将其平均分成甲、乙两组,并在相同的适宜条件下培养;
第二步:对甲组幼苗定期喷施适当浓度的赤霉素溶液,同时乙组幼苗喷施等量的蒸馏水;
第三步:观察并测量两组玉米植株的平均高度;
实验结论:病毒的作用是抑制了赤霉素的合成。
| |