|
第I卷 选择题
1.下列有关圆褐固氮菌的叙述中,不正确的是:
A.同化作用类型为自养型
B.疏松土壤可使固氮能力加强
C.用菌剂拌种可提高作物产量
D.在缺乏氮素的培养基上可生长
2.下列物质的生理作用不具有专一性的是:
A.胰蛋白酶
B.载体蛋白
C.聚乙二醇
D.tRNA
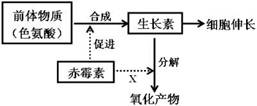
3.赤霉素与生长素都能促进茎秆的伸长,两者关系如图所示,下列叙述中正确的是:
|
A.赤霉素对生长素的分解有促进作用
B.赤霉素与生长素的间表现为协同作用
C.色氨酸一般由植物从土壤中主动运输吸收获得
D.植物的生长发育过程起主要作用的是赤霉素 |
|
4.某人因花粉过敏导致哮喘,下列叙述不合理的是:
A.有遗传倾向,不属于自身免疫病
B.效应T细胞不参与该过敏反应过程
C.初次接触花粉时效应B细胞释放组织胺
D.一般对气管等呼吸器官不造成严重损伤
5.成年健康小白鼠下丘脑的部分结构被破坏后,其代谢状况与环境温度的关系如下图,可能出现的情况是:
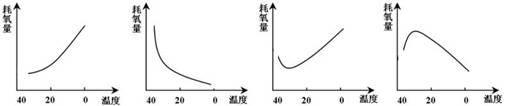
A B C D
可能用到的相对原子质量:H1 C12 O16 Al 27 S32 Cl35.5 Ba137
6.国家提出经济发展要“又好又快””,要“环境友好和可持续发展”” 。下列行为违反这一主题的是
A.将煤液化或气化并对产品进行综合利用
B.以植物秸秆为原料制生物柴油
C.在高速公路路面大范围地使用融雪剂
D.以“设计绿色化工工艺,提高原子利用率”为目标进行产业换代
7.下列事实与胶体性质无关的是
①在豆浆里加入盐卤做豆腐;②牛油与烧碱溶液共煮,向反应后所得的溶液中加入食盐,则有固体析出;③一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路;④三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀;⑤肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗;⑥水泥、冶金厂常用高压电除去工厂烟尘,以减少对空气污染。
A.②④ B.④ C.③⑤ D.①⑥
8.以下实验或操作不能达到目的的是
A.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
B.用溴水鉴别苯、乙醇、四氯化碳
C.用滴定管量取8.00mL的2mol/L NaCl溶液
D.用稀硫酸清洗长期存放氯化铁溶液的试剂瓶内壁
9. 已知:H2(g)+F2(g)= 2HF(g);△H=-270 kJ/mol,下列说法正确的是
A.2 L HF气体分解成1 L的H2和1 L的F2吸收270 kJ热量
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.NA个H2分子与NA个F2分子反应生成2NA个HF分子吸收270 kJ热量在相同条件下
D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
10.氯酸质量分数超过40%时会发生分解,反应可表示为:8 HClO3 = 3 O2↑ 2 Cl2↑ 4 HClO4 2 H2O,下列说法正确的是
A.氧化性比较HClO4 > HClO3
B.氧化产物只有HClO4
C.氯酸分解后的混合气体平均相对分子质量为47.6
D.该反应转移电子数为12e—
11.用NA表示阿伏加德罗常数的数值,下列说法中一定正确的是
A.常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA
B.4.8g 镁与足量盐酸反应时,转移0.2NA个电子
C.铁、铜和稀硫酸构成原电池,当转移了NA个电子时,产生的气体体积一定为11.2 L
D.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
12.下列说法中,不正确的是
A. 弱酸HX溶液的pH=3,加水稀释100倍, 3< pH <5
B. 在0.1mol·L-1的CH3COOH中加入少量的CH3COONa固体,溶液中c(H )减小
C. 在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3 不可能大量存在
D. 室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
13.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g) 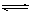 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.若升高温度,X的体积分数增大,则正反应的△H>0
B.以X浓度变化表示的反应速率为0.001mol/(L·s)
C.若增大压强,则物质Y的转化率减小
D.若将容器体积变为20L,则Z的平衡浓度变为原来的1/2
二、选择题(本题共8小题。在每小题给出的四个选项中,有的只有一个选项正确,有的有多个正确选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分)
14. 下列说法中正确的有
A.热量能够从高温物体传到低温物体,但不能从低温物体传到高温物体
B.当分子间的距离增大时,分子间的引力和斥力都在减小,但斥力减小得更快,所以分子间作用力总表现为吸引力
C.温度是物体分子热运动的平均动能的标志,因而绝对零度是不可能达到的
D.气体压强的大小只与气体分子的密集程度有关
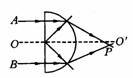 15.如图所示, 15.如图所示, 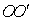 是半圆柱形玻璃体的对称面和纸面的交线,A、B是关于 是半圆柱形玻璃体的对称面和纸面的交线,A、B是关于 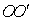 轴等距且平行的两束不同单色细光束,从玻璃射出后相交于 轴等距且平行的两束不同单色细光束,从玻璃射出后相交于 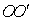 下方的P点,由此可以得出的结论是 下方的P点,由此可以得出的结论是
A.在玻璃中,A光比B光的速度小
B.玻璃对A光的折射率比对B光的折射率小
C.单色光 A光的波动性比B光显著
D.A光的光子能量比B光的光子能量小
16.下列说法中正确的是
A.氡的半衰期有3.8天,若有一定数量的氡原子核,经7.6天后就一个氡原子核也没有了
B.许多元素能自发地放出射线,使人们开始熟悉到原子核是有复杂结构的
C.卢瑟福在  粒子散射实验中发现了电子 粒子散射实验中发现了电子
D. 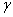 射线一般伴随着 射线一般伴随着  或 或  射线产生,它的穿透能力在三者中是最弱 射线产生,它的穿透能力在三者中是最弱
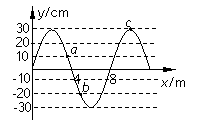 17. 如图所示为某介质中一列简谐横波的图象,若波的周期为2.0s,a、b、c 为介质中三个相同的质点。以下说法正确的是 17. 如图所示为某介质中一列简谐横波的图象,若波的周期为2.0s,a、b、c 为介质中三个相同的质点。以下说法正确的是
A.波的传播速度为4m/s
B.若这一时刻b点的速度方向沿y轴正方向,则
波沿x轴负方向传播
C.图示时刻质点 a、b、c 的加速度大小之比为
1∶2∶3
D.经过l.0 s,质点 a、b、c 通过的路程均为60cm
18.均匀分布在地球赤道平面上空的三颗同步通信卫星能够实现除地球南北极等少数地区外的“全球通信”.已知地球半径为R,地球表面的重力加速度为g,同步卫星所在轨道处的重力加速度为g',地球自转周期为T,下面列出的是关于三颗卫星中任意两颗卫星间距离s的表达式,其中正确的是
A. 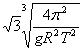 B. B. 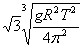 C. C. 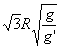 D. D. 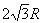
19.如图,有一理想变压器,原副线圈的匝数比为n.原线圈接正弦交流电压U,输出端接有一个交流电流表和一个电动机.电动机线圈电阻为R.当输入端接通电源后,电流表读数为I,电动机带动一重物匀速上升.下列判定正确的是
A原线圈中的电流为nI B. 变压器的输入功率为UI/n.
C. 电动机输入的功率为I2R D. 电动机两端电压为IR
SHAPE \* MERGEFORMAT
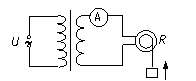 
20.如图所示,长为L的长木板水平放置,在木板的A端放置一个质量为m的小物块,现缓慢地抬高A端,使木板以左端为轴转动,当木板转到与水平面的夹角为 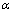 时小物块开始滑动,此时停止转动木板,小物块滑到底端的速度为v,则在整个过程中 时小物块开始滑动,此时停止转动木板,小物块滑到底端的速度为v,则在整个过程中
 A.支持力对物块做功为0 A.支持力对物块做功为0
B.支持力对小物块做功为mgLsinα
C.摩擦力对小物块做功为mgLsinα
D.滑动摩擦力对小物块做功为
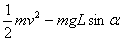
21.如图所示,abcd是位于竖直平面内的正方形闭合金属线框,在金属线框的下方有一匀强磁场区域, MN和M ′N ′是匀强磁场区域的水平边界,并与线框的bc边平行,磁场方向与线框平面垂直。现金属线框由距MN的某一高度从静止开始下落,图二是金属线框由开始下落到完全穿过匀强磁场区域瞬间的速度-时间图象。已知金属线框的质量为m,当地的重力加速度为g,图像中坐标轴上所标出的字母均为已知量。根据题中所给条件,以下说法正确的是
A.可以求出金属框的边长
B.可以求出磁场的磁感应强度
C.可以求出金属线框在进入磁场过程中所通过线框某一横截面的电量
D.可以求出金属线框在整个下落过程中所产生的热量
SHAPE \* MERGEFORMAT
第II卷 非选择题
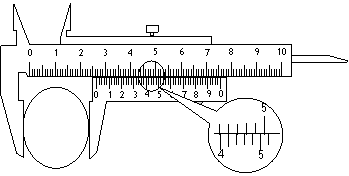 22.(17分)I (4分)用螺旋测微器测量一根电阻丝的直径,测量结果如图,其读数为 _ ___mm。用游标为50分度的卡尺测量一工件的直径,测量结果如图所示,此工件的直径为________cm。 22.(17分)I (4分)用螺旋测微器测量一根电阻丝的直径,测量结果如图,其读数为 _ ___mm。用游标为50分度的卡尺测量一工件的直径,测量结果如图所示,此工件的直径为________cm。
Ⅱ:(本题13分)某学习小组通过实验来研究电器元件Z的伏安特性曲线。他们在实验中测得电器元件Z两端的电压与通过它的电流的数据如下表:
|
U/V |
0.0 |
0.2 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
|
I/A |
0.000 |
0.050 |
0.100 |
0.150 |
0.180 |
0.195 |
0.205 |
0.215 |
现备有下列器材:
A.内阻不计的6V电源;
B.量程为0~3A,内阻约为0.06Ω的电流表;
C.量程为0~0.6A,内阻约为5Ω的电流表;
D.量程为0~15V,内阻约为5×104Ω的电压表;
E.量程为0~3V,内阻约为l04Ω的电压表;
F.阻值为0~10Ω,额定电流为3A的滑动变阻器;
H.电键和导线若干。
(1)这个实验小组在实验中电压表选的是 ;电流表选的是 。(填器材前面的字母)
(2)分析上表内实验数据可知,应选用的实验电路图是图
(填“甲”或“乙” )
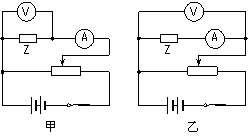
丙
(3)在图丙中将所选器材,用笔画线代表导线进行实物连线;
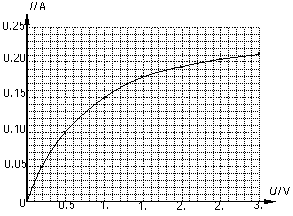 (4)利用这些数据绘出的用电器Z的伏安特性曲线 (4)利用这些数据绘出的用电器Z的伏安特性曲线
如图所示,请根据这些数据和图线解决下列问题:
 ①分析曲线可知小灯泡的电阻随U变大而 ①分析曲线可知小灯泡的电阻随U变大而
(填“变大”、“变小”或“不变” );
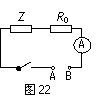
②若把用电器Z接入如图所示的
电路中时,电流表的读数为0.100A,已知A、B两端电压恒为1.5V,则定值电阻R0阻值为________Ω。
23.(16分)一质量m=2.0kg的小物块以一定的初速度冲上一倾角为37º足够长的斜面,某同学利用传感器测出了小物块冲上斜面过程中多个时刻的瞬时速度,并用计算机做出了小物块上滑过程的速度—时间图线,如图所示。(取sin37º=0.6 cos37º=0.8 g =10m/s2)求:
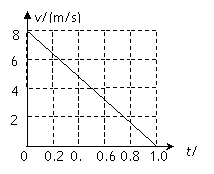 (1)小物块冲上斜面过程中加速度的大小; (1)小物块冲上斜面过程中加速度的大小;
(2)小物块与斜面间的动摩擦因数;
(3)小物块向上运动的最大距离。
24.(19分)一质量m=20kg的小车停放在光滑固定轨道ABCDE的A点处,如图所示,轨道的AB段是水平的,CDE段是一段R=20m的圆弧,圆弧的最高点D比AB高出h=1.25m.。有一质量M=60kg的人以v0的水平速度跳上小车,并与小车一起沿轨道滑行,不计一切阻力。试计算当人的速度v0多大时,小车滑行到D点时对轨道的压力恰好为零?(g取10m/s2)(
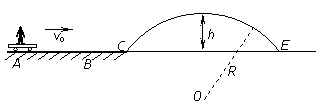
25.(20分)如图所示,真空中有(  ,0)为圆心,半径为 ,0)为圆心,半径为  的圆柱形匀强磁场区域,磁场的磁感应强度大小为B,方向垂直于纸面向里,在 的圆柱形匀强磁场区域,磁场的磁感应强度大小为B,方向垂直于纸面向里,在 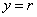 的虚线上方足够大的范围内,有方向水平向左的匀强电场,电场强度的大小为 的虚线上方足够大的范围内,有方向水平向左的匀强电场,电场强度的大小为 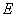 ,从 ,从 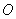 点向不同方向发射速率相同的质子,质子的运动轨迹均在纸面内,设质子在磁场中的偏转半径也为 点向不同方向发射速率相同的质子,质子的运动轨迹均在纸面内,设质子在磁场中的偏转半径也为  ,已知质子的电量为 ,已知质子的电量为 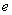 ,质量为 ,质量为 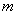 ,不计重力及阻力的作用,求 ,不计重力及阻力的作用,求
(1)质子射入磁场时的速度大小
(2)速度方向沿 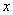 轴正方向射入磁场的质子,到达 轴正方向射入磁场的质子,到达 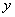 轴所需的时间 轴所需的时间
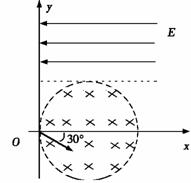 (3)速度方向与 (3)速度方向与 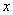 轴正方向成 轴正方向成 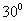 角(如图中所示)射入磁场的质子,到达 角(如图中所示)射入磁场的质子,到达 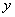 轴的位置坐标。要求画出质子运动轨迹的示意图。 轴的位置坐标。要求画出质子运动轨迹的示意图。
26.(10分)五种短周期元素A、B、C、D、E,原子序数依次增大,C原子最外层电子数是A、B、D三种原子的最外层电子数之和, C可分别与A、B、D三种元素形成原子个数比为1:1的化合物甲、乙、丙,C与E是同族元素,B与E可形成原子个数比为1:2的化合物丁,E的最外层电子数是最内层电子数的3倍。请回答:
(1)具有相同电子数和原子数的分子互称为等电子体,写出由短周期元素组成的与乙互为等电子体的分子__________(用化学式表示)。
(2) B的氧化物分子中各原子最外层均为8电子结构的电子式为 。
(3)丙中所含的化学键类型为 。把一定量的丙固体分别加入下列物质的溶液中,不可能出现浑浊现象的是 _________。
①饱和H2S溶液 ②Na2SO3稀溶液 ③Ca(HCO3)2稀溶液 ④K2CO3稀溶液
(4)常温下丁是一种液体,加热到423K可与水反应生成两种酸性气体,写出此化学方程式。______________________________________________________
27. (18分) A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。
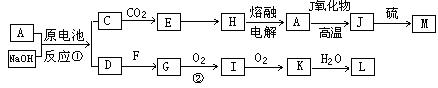
请回答以下问题:
(1)写出原电池的负极反应方程式______________________________________。
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为_________________(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者_______后者(用“>”、“<”或“=”表示)。
(3)金属A的氯化物沸点较低,又易升华,能否电解这种熔融氯化物来生产A?__________。原因是________________________________________________________________。
(4)写出②的化学方程式____________________________________________________。
(5)写出A→J反应的化学方程式 。
(6)含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色。
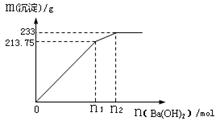 ①水溶液与NaHCO3溶液混合,反应的离子方程式为 ①水溶液与NaHCO3溶液混合,反应的离子方程式为
___________ ___。
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图:
请回答:X晶体的俗名为__________;其溶液的物质的量浓度为_________mol/L。
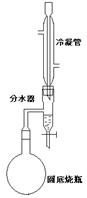 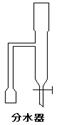 28.(15分)某实验小组欲制取苯甲酸乙酯(沸点213℃),主要实验仪器有:圆底烧瓶、分水器(如下图)、冷凝管,其他夹持装置及胶塞等略。 28.(15分)某实验小组欲制取苯甲酸乙酯(沸点213℃),主要实验仪器有:圆底烧瓶、分水器(如下图)、冷凝管,其他夹持装置及胶塞等略。
实验步骤如下:
I.取100ml圆底烧瓶,向其中分别加入以下三组试剂:①12.2g苯甲酸(其沸点为122℃,,相对分子质量为122)和2粒沸石②8ml(足量)无水乙醇 ③适量的浓硫酸
II. 如图所示连接实验装置,加热圆底烧瓶中的混合液,使反应产生的水蒸气经冷凝管冷凝回流到分水器中,通过分水器分离出来,用锥形瓶承接收集产生的水。
III. 当不再有水生成,停止加热。
IV. 冷却后,用饱和碳酸钠水溶液洗涤圆底烧瓶中的混合液并分液。
V. 取上层(有机层)混合液减压蒸馏,得到较为纯净的苯甲酸乙酯。
根据以上操作过程回答以下问题:
(1)反应过程中浓硫酸有提高苯甲酸乙酯产率的作用,其原理为
(2)用冷凝管冷凝时,冷水应该从 口进入,从 口流出;(填“上”或“下”)
(3)操作步骤IV中,用饱和碳酸钠溶液洗涤反应后的混合液目的是
①洗去反应剩余的苯甲酸 ②洗去反应混合液中的乙醇
③降低苯甲酸乙酯的溶解度,有利于析出、分层,便于下一步的分液
④有利于苯甲酸乙酯的水解
(4)写出该反应的化学方程式
(5)实验过程中,假如温度过高会发生副反应,产生一种能使溴的四氯化碳溶液褪色的
无色稍有气味的气体,该气体的结构简式为
(6)实验结束收集分水器分离出的水,并测得质量为1.44g,计算苯甲酸乙酯的产率为 。实验中苯甲酸乙酯的实际产率总是小于此计算值,其原因可能是
①加热过程中乙醇挥发,冷凝后滴入分水器中,随冷凝的水一起被分出
②实验过程中,发生了副反应
③苯甲酸乙酯洗涤、蒸发过程中有损失
29.(178分) 已知芳香族化合物A、B、C、D的化学式均满足C8H8Ox,请按要求回答下列问题:
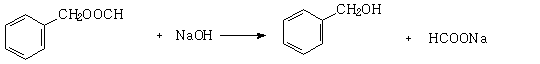
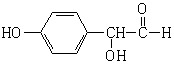
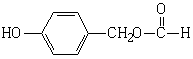
(1)A、B、C均为x=2的苯环上只有一个侧链的化合物,三者在碱性条件下可以发生如下反应:
NaOH溶液 酸化
  A E(C7H6O2) F A E(C7H6O2) F
NaOH溶液 酸化
  B M(C6H6O) J B M(C6H6O) J
NaOH溶液 酸化
  C N(C7H8O) P C N(C7H8O) P
①写出C在NaOH溶液中应的化学方程式 。
反应类型为 。
②设计实验鉴别E、M、N(填写下列表格,步骤可不填满)
(2)D为x=3的芳香族化合物,请写出两个只有两个对位取代基,且能发生银镜反应的有机物的结构简式 。
(3)当x=4时其中有一种化合物的结构简式为: 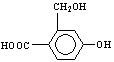 为实现以下物质的转化 为实现以下物质的转化
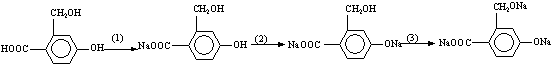
请用化学式填写下列空白处所需加入的适当试剂① ②
③ 。
30.(24分)回答下列I、II小题:
I.(10分)近期研究表明,我们面对新信息时大脑中需要建立起一个新的处理路径。此时,被新信息激活的神经元会生长出新的突起,一直延伸到邻近的神经元,形成突触。突触一旦形成,兴奋就可以从一个神经元传到另外一个神经元,我们也就获得了新的信息。若建立起的突触失灵了,大脑就忘记了这个信息。
(1)大脑在初次学习时需要的时间比再次学习时需要的时间长,原因是再次学习时不需要______________________;而随年龄的增长,神经元衰老,获得新信息需要的时间更长,是由于_______________________。
(2)突触形成后,兴奋在神经纤维上的传导是___________(单向/双向)。
(3)有关研究表明,人在安静时大脑的产热量是运动时的6倍,则人在_________时更轻易记忆,原因是在该情况下脑细胞__________________强。
II.(14分)某池塘的水层由上至下分别为表水层、斜温层、静水层和底泥层,在冬夏两季分别对该池塘的温度和氧气进行垂直结构分析,统计数据如下表:
|
水 层 |
表水层 |
斜温层 |
静水层 |
底泥层 |
|
温度(℃) |
夏 |
25 |
14 |
8 |
4 |
|
冬 |
2 |
3.8 |
4 |
4 |
|
O2(μL·L-1) |
夏 |
9.5 |
6.2 |
3.4 |
0.2 |
|
冬 |
12 |
11.8 |
10.6 |
10.2 |
(1)从表中数据分析,夏季池塘中随着水深的增加,O2含量下降,引起这种现象的非生物因素主要是________________________;夏季各水层的O2含量低于冬季,其生物学原因是_____________________________________________________________________。
(2)夏季底泥层和表水层相比,O2含量非常低的原因是_______________________________
____________________________________________________。
(3)某同学为了测定斜温层水样的总光合作用生产量,先测出该水层的原始溶氧量,再取两个无色透明玻璃瓶A、B,其中A瓶先包上黑胶布,再包以锡箔,B瓶不包裹。在A、B两瓶内装入等量水样,密封后沉入水中一定深度,24小时后取出测定。
①在实验中,A、B两瓶密封后沉入水中“一定深度”,此深度指______________深度。
②A瓶中所测得的数据可以得知正常的____________________量(设为a),B瓶中含氧量的变化可以确定____________________量(设为b),则利用A、B两瓶的测量数据就可以计算出光合作用生产量为____________________。
31.(18分)杂种优势是指两个遗传组成不同的亲本杂交产生的F1,在生活力、繁殖力、抗逆性、产量和品质等方面都优于双亲的现象。显性假说和超显性假说都可以解释杂种优势。
(1)显性假说认为杂种优势是由于双亲的各种显性基因全部聚集在F1引起的互补作用。如豌豆有两个纯种(P1和P2)的株高均为1.5~1.8米,但其性状有所不同,亲代P1多节而节短,亲代P2少节而节长,杂交后F1集中双亲显性基因,多节而节长,可达到2.1~2.4米,表现杂种优势。请利用遗传图解和必要文字解释这一现象(多节与少节、节长与节短分别由两对位于非同源染色体上等位基因控制,设A和a,B和b)。
(2)超显性假说则认为等位基因的作用优于相同基因,可以解释杂种优于纯合亲本。例如,豌豆某一位点上的两个等位基因(A1、A2)各抗一种锈病。请利用遗传图解和必要文字解释两个只抗一种锈病的亲本杂交后代抗两种锈病的原因。
(3)假设豌豆高产与低产由两对同源染色体上的两对等位基因(A与a,B与b)控制,且含显性基因越多产量越高。现有高产与低产两个纯系杂交得Fl,Fl自交得F2,F2中出现了高产、中高产、中产、中低产、低产五个品系。
①F2中,中产的基因型为________________________________________;
②F2中高产、中高产、中产、中低产、低产五个品系性状分离比为________________。
2009年东北三省三校第一次模拟考试理科综合参考答案
第I卷 选择题
1.A 2.C 3.B 4.C 5.B 6. C 7.B 8.A 9. D 10. C 11. A 12.C 13.B
14. C 15 .A 16.B 17.ACD 18. BC 19.B 20. BD 21. AD
第II卷 非选择题
22 I 0.590 2.642
 每空2分,共4分。 每空2分,共4分。
Ⅱ(1)E;C
(2)甲
(3)连接实物图
(4)①变大 ②10Ω
(1)每空1分(2)3分(3)4分(4)每空2分。
23.
(1)由小物块上滑过程的速度—时间图线,可知: 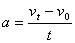 (3分) (3分)
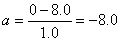 m/s2 (1分) m/s2 (1分)
小物块冲上斜面过程中加速度的大小为8.0m/s2。
(2)小物块受重力、支持力、摩擦力,沿斜面建立直角坐标系,
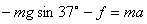 (2分) (2分)
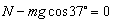 (2分) (2分)
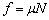 (2分) (2分)
代入数据解得 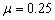 (2分) (2分)
(3)设物块冲上斜面所能达到的最高点距斜面底端距离为s,
向上运动阶段 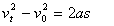 (3分) (3分)
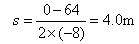 (1分) (1分)
24.解:小车在半径为R的圆周上作圆周运动,处于圆周轨道的最高点时,小车和人所受重力之和提供向心力,设小车滑行到D点时的速度为u,根据牛顿第二定律
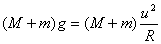 (4分) (4分)
得u=10 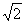 m/s (2分) m/s (2分)
设人和小车以共同速度v ,从水平面运动到D的过程中机械能守恒,根据机械能守恒定律得
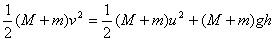 (4分) (4分)
v=15m/s (2分)
在人接触小车,并使小车和人一起前进的过程中,无水平方向外力作用,故水平方向上动量守恒,得
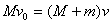 (4分) (4分)
v0=20m/s (3分)
25.(1)质子射入磁场后做匀速圆周运动,有
evB=mv2/r (3分)
可得v=eBr/m (1分)
(2)质子沿x轴正向射入磁场后经1/4圆弧后以速度v垂直于电场方向进入电场,周期为
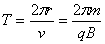 (2分) (2分)
在磁场中运动的时间
t1=T/4=πm/2eB (1分)
进入电场后做抛物线运动,沿电场方向运动r后到达y轴,因此有
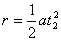 (1分) (1分)
t2= 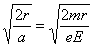 (1分) (1分)
所求时间为t= t1 t2= 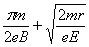 (1分) (1分)
(3)质子在磁场中转过120°角后从P点垂直电场线进入电场,如图所示。
P点距y轴的距离
x1=r rsin30°=1.5r 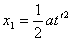 (2分) (2分)
因此可得质子从进入电场至到达y轴所需时间为 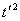 = = 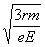 (2分) (2分)
质子在电场中沿y轴方向做匀速直线运动,因此有
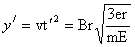 (2分) (2分)
质子到达y轴的位置坐标为 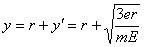 即(0,r 即(0,r 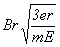 ) (2分) ) (2分)
图 (2分)
26.(10分)(1)N2 (2分)
(2) (2分,如写出CO正确的电子式也给分)
(3)离子键、非极性键。(2分,第二空答共价键也给分) ②④ (2分,答案全正确给分)
(4)CS2 2H2O  CO2 2H2S(2分) CO2 2H2S(2分)
27.(18分)(1)Al 4OH-–3e- = AlO2- 2H2O(2分)
(2)10-2–10-12 mol/L, 或c(OH-)–c(H ) (2分) < (2分)
(3)否(1分);因为A的氯化物熔沸点低,据此判定它的晶体为分子晶体,在熔融态时不电离,不能被电解(2分)。
(4)4NH3 5O2 4NO 6H2O (2分,条件错误扣1分)
(5)Fe2O3 2Al == 2Fe Al2O3 (2分,写Al和Fe3O4反应也给分)
(6)①Al3 3HCO3- = Al(OH)3↓ 3CO2↑ (2分,无↓和↑扣1分)
②明矾或白矾(1分); 1mol/L(2分)
28.(15分)(1)吸收反应产生的水,降低生成物浓度,使平衡正向移动。(2分)
(2)a,b (2分,每空1分)
(3)①②③ (2分,答案完全正确给分)
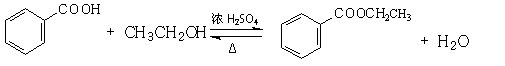 (4) (4)
(3分,条件错误扣1分)
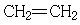 (5) (2分) (5) (2分)
(6)80% (2分) ①②③ (2分,答案完全正确给分)
 29.(17分)(1)① 29.(17分)(1)①
(2分) 取代反应 (1分,答水解反应给分)
②
|
步骤 |
所用试剂 |
现象 |
结论 |
|
1 |
FeCl3溶液 |
溶液呈紫色 |
为M |
|
2 |
NaHCO3溶液 |
出现无色气体 |
为E;另一物质为N |
|
3 |
|
|
|
|
4 |
|
|
|
  (7分,前五个空每空一分,最后一空两结论各一分。本题其它合理答案均给分) (7分,前五个空每空一分,最后一空两结论各一分。本题其它合理答案均给分)
(2)
(4分,各2分,其它合理答案也给分)
(3)①NaHCO3 ②NaOH或Na2CO3 ③ Na (3分,各1分)
30.(24分)
I.(10分)
(1)新建立突触(2分);突触建立时间更长(2分)。(2)双向 (2分) (3)安静(2分);呼吸作用(2分)。
II.(14分)
(1)光(1分)和温度(1分);夏季各水层生物的呼吸作用强(2分) 。
(2)底泥层几乎没有植物分布(1分),生活着大量需氧型的生物(1分)。
(3)①斜温层(或被测定的水层或取样水层)(2分);
②呼吸作用量(或呼吸耗氧量)(2分);净光合作用量(或光合作用氧气积累量)(2分);
a b(2分)(文字表述正确亦可)。
31.(18分)(1)(4分)
P AAbb × aaBB
多节节短 少节节长
↓
F1 AaBb
多节节长
F1代具有A和B基因,表现为节多而且节长,故较高。
(2)(4分)
P AlAl × A2A2
抗一种锈病 抗一种锈病
↓
F1 AlA2
抗两种锈病
F1 AlA2具有两种抗锈病基因,能抗两种锈病。
(3)①AaBb(2分)、AAbb(2分)、aaBB(2分);
②1:4:6:4:1(4分)。
|