| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
A.在接种前如需要扩大培养可采用调低培养基碳源和氮源比值的方法 B.a–e 阶段,酵母菌进行二分裂并以等比数列的形式增加 C.采用a–e 阶段的细菌作菌种可以缩短生产周期,采用连续培养法可以延长f–h阶段
5.某草原因过度放牧和鼠害导致荒漠化。为了遏止鼠害对草原的破坏,放入驯化后的银黑狐捕鼠。右图中的曲线分别代表羊、鼠和狐数量的年变化,这3条曲线正确对应的动物是( ) A.甲为狐、乙为鼠、丙为羊 B.甲为鼠、乙为羊、丙为狐 C.甲为狐、乙为羊、丙为鼠 D.甲为羊、乙为鼠、丙为狐 (注:左Y轴数值对应甲、乙曲线,右Y轴数值对应丙曲线)
速充入容器,封闭A。反应N2 3H2
7.研究显示将水倒入含有镓的铝液态合金的容器后,其反应可以将水当中的氧和氢分开來,这个过程中就能释放出氢燃料,镓的铝合金对水中的氧产生很强的吸附力,使氢在水中 被释放出來。这整个反应的过程中,镓是要害性因素,由于镓可以阻止铝因暴露在空气中形成一层保护膜,加入镓后,铝就能在水中与氧持续不断结合产生氢燃料。这一发现可能会使发动机本质上要燃烧水,而不是汽油,这是因为镓在反应中不会被消耗,而铝能被循环使用。有关说法正确的是( ) A.与水反应生成的铝氧化物,在高温下熔融,用氢气还原可制得铝 B.镓对反应有催化作用 C.铝与水反应的离子方程式为:2Al 2OH- 2H2O = 2AlO2- 3H2↑ D.镓元素位于周期表第四面期第ⅢA族 8.镁及其化合物一般无毒(或低毒).无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为( )
x Mg Mo3S4 Mgx Mo3S4 ;在镁原电池放电时,下列说法错误的是( ) A.Mg2 向正极移动 B.正极反应为:Mo3S4 2xe- = Mo3S42x- C.Mo3S4发生氧化反应 D.负极反应为:xMg - 2xe- = xMg2 9.A.B.C三种物质,每个分子中都含有18个电子且B.C均为两种元素组成的化合物。其中A的分子属于非极性分子,且只有非极性键;B的分子由四个原子构成,既有极性键也有非极性键;C的分子由八个原子构成。A.B.C在常温下状态分别是( ) A.固、液、液 B.气、液、气 C.液、液、气 D.气、气、气 10.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是: ①CH3OH(g)+H2O(g) ==== CO2(g)+3H2(g);DH1 = 49.0 kJ·mol-1 ②CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g);DH2=-192.9 kJ·mol-1
A.CH3OH的燃烧热DH =-192.9 kJ·mol-1 B.反应②中的能量变化如图所示,则DH2=E1-E3 C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量 D.根据②推知:在25℃,101kPa时,1molCH3OH(g)燃烧生成CO2和H2O放出热量应大于192.9kJ 11.下列混合溶液中,各离子浓度的大小顺序正确的是( ) A.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合: C(Cl—)> C(NH4 )> C(OH—)>C(H ) B.10mL0.1mol/L NH4Cl溶液与5mL0.2mol/L NaOH溶液混合: C(Na )=C(Cl-)>C(OH-)>C(H ) C.10mL0.1mol/LCH3COOH溶液与5mL0.2mol/L NaOH溶液混合: C(Na )=C(CH3COO-)>C(OH-)>C(H )
C(Cl—)>C(Na )> C(OH-)>C(H ) 12.如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g某金属,下列说法正确的是( ) A.甲池是b极上析出金属银,乙池是c极上析出某金属 B.甲池是a极上析出金属银,乙池是d极上析出某金属 C.某盐溶液可能是CuSO4溶液 D.某盐溶液可能是Mg(NO3)2溶液 13.常温下,将1.92 g Cu加入到100 mL硫酸和硝酸的混合溶液中,铜全部溶解并放出无色气体,再向该溶液中加入足量的Fe粉充分反应,此时收集到的气体全部是氢气且在标准状况下的体积为448 mL。下列说法中正确的是( ) A.原混合液中n(NOeq \o(\s\up 0(-),\s\do 0(3))-3)=0.08 mol B.原混合液中c(SOeq \o(\s\up 0(2-),\s\do 0(4 ))2-4 )=0.2 mol/L C.原混合液中pH=1-lg1.2 D.溶解的Fe粉质量为2.8 g 二、选择题(本题包括8小题,共48分。每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分) 14.质量为m的汽车以速度v沿倾角为θ的倾斜路面匀速向上行驶,若保持汽车的功率p不变,汽车以3v的速度沿这个倾斜路面向下匀速行驶,由此可知汽车与这段倾斜路面间的动摩擦因数为( ) A. 15.一定质量的理想气体,从某一状态开始,经过一系列变化后又回到开始的状态,用W1表示外界对气体做功的数值,W2表示气体对外界做功的数值,Q1表示气体吸收热量的多少,Q2表示气体放出热量的多少,则在整个过程中可能正确的关系是( ) A.| Q1—Q2|>|W2—W1| B.Q1=Q2, W1=W2 C.Q1>Q2,W1<W2 D.Q1>Q2,W1>W2 16.质量为m的小物块,在与水平方向成α角的力F作用下,沿光滑水平面运动,物块通过A点和B点的速度分别是vA和vB,物块由A运动到B的过程中,力F对物块做功W和力F对物块作用的冲量I的大小是( )
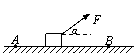 A. A. C.I=mvB- mvA D.I>mvB- mvA 17.两列简谐横波在同一个介质中以相同的速度相向传播,t=0时刻,这两列波的波动图像如图所示.其中简谐横波a(图中虚线所示)沿x轴的正方向传播,简谐横波b(图中实线所示)沿x轴的负方向传播,已知位于x=45m处的质点P第一次通过平衡位置的时间为0.5s,则波的传播速度为( )
A.10m/s B.30m/s C.50m/s D.70m/s 18.右图是一个将电流表改装成欧姆表的示意图,此欧姆表已经调零,用此欧姆表测一阻值为R的电阻时,指针偏转至满刻度4/5处,现用该表测一未知电阻,指针偏转到满刻度的1/5处,则该电阻的阻值为( ) A.4R B.5R C.10R D.16R 19.某人骑自行车在平直道路上行进,图中的实线记录了自行车开始一段时间内的v-t图象,某同学为了简化计算,用虚线作近似处理,下列说法正确的是( )
B.在0-t1时间内,由虚线计算出的平均速度比实际的大 C.在t1-t2时间内,由虚线计算出的位移比实际的大 D.在在t3-t4时间内,虚线反映的是匀速运动 20. 2008年9月25日21时10分,我国成功发射了“神舟七号”宇宙飞船,实现了我国航天技术的又一突破——首次航天员太空行走。航天员翟志刚在出舱活动过程中始终有一只手抓住舱外的扶杆,若他松手完全脱离飞船,“神舟七号”飞船将( ) A.速度增大 B.加速度减小 C.轨道半径不变 D.周期变大
A.若A、B为异性电荷,B球一定做圆周运动 B.若A、B为异性电荷,B球可能做匀变速曲线运动 C.若A、B为同性电荷,B球一定做远离A的变加速曲线运动 D.若A、B为同性电荷,B球的动能一定会减小 三、非选择题 22.本实验题包括两道小题,共18分。 \* MERGEFORMAT A.应选用质量较大的重锤,使重锤和纸带所受的阻力远小于重锤的重力 B.应选用质量较小的重锤,使重锤的惯性小一些,下落时更接近自由落体 C.重锤的质量对验证机械能守恒定律实验数据的计算没有影响,所以无需测量重锤的质量 D.重锤的质量对验证机械能守恒定律的实验结果影响很大,应该用天平测量
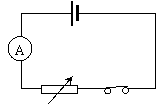
①同学们通过查阅资料知道将锌、铜两电极插入水果中,电动势约为1V。晓宇同学找来了一个土豆做实验,当用量程为0~3V、内阻约50kΩ的伏特表测其两极时读数为0.96V。但当他将四个这样的水果电池串起来给标称值为“3V,0.5A”的小灯泡供电时,灯泡并不发光。检查灯泡、线路均没有故障,而用伏特表测量其电压确实能达到3V多。据您猜想,出现这种现象的原因应当是: (不要求写分析、推导过程)。
26.(16分)某研究性学习小组在查阅资料时发现,化工厂常用氨气来检验氯气是否泄漏,于是它们设计实验来探究氯气与氨气之间的反应。该小组设计的实验装置如下图:
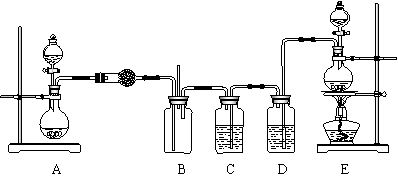
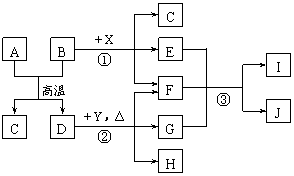
实验可用药品有:a.二氧化锰 b.浓盐酸 c.浓氨水 d. 氯化铵 e.碱石灰 f.浓硫酸 g.饱和食盐水 h. NaOH固体 i.消石灰 请回答下列问题: (1)实验室制备氨气有多种方法。通常用加热固体混合物的方法制备氨气,反应的化学方程式是 ,本实验中装置A烧瓶内的固体可选用 (填上述给定药品的序号)。 (2)装置E的烧瓶中发生反应的化学方程式是 。 (3)装置D中盛装的药品是 (填序号),装置C的作用是 。 (4)通入B装置的两根导管左边的较长.右边的较短,其目的是 。 (5)实验中观察到装置B内出现浓厚的白烟,并在容器壁上凝聚成白色固体,将该固体溶于水,所得溶液中离子浓度由大到小的顺序为 。 (6)已知,在水溶液中能发生反应3Cl2+2NH3===N2+6HCl,假如氯气过量,一种产物分子的空间构型与NH3相似,该反应的化学方程式是 。 27.(14分)下图表示几种无机物之间的转化关系。其中A.B均为黑色粉末,C为无色气体,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。
 请回答下列问题: 请回答下列问题:
(1)A的化学式是 ,C的电子式是 ,Y 的名称是 。 (2)反应①的化学方程式为 。 (3)实验室测定气体E的相对分子质量时,得到的实验值总是比理论值偏大。要准确测定E的相对分子质量,最适宜的条件是_________。 a.高温高压 b.低温低压 c.高温低压 d.低温高压 (4)用石墨作电极电解H的水溶液,电解总反应的离子方程式是 。 (5)推测反应③的还原产物可能是 。 28.(15分)天文学家在星际云中发现了一种高对称的有机分子Z,在紫外线辐射或加热条件下,可转化为许多生命的前物质,这些事实支持了生命来自星际的假说。有实验证实,Z的形成过程如下:
其中A、B、C、D是中学化学常见的含有10电子的多核离子或分子,Y、Z的结构式表示如下:
试回答下列问题: ⑴ A、B的电子式分别是A B 。 ⑵ C与D相似,液态C也可发生微弱的电离,电离出A和与A等电子数的另一种微粒。金属钠能与液态C发生反应:Na C→W H2↑,写出在液态C中W与NH4Cl反应的化学方程式 。 ⑶ 反应①②③中属加成反应的是 。 ⑷ X的结构简式 。 ⑸ 在Z的分子中六元环的数目为 。 ⑹ 若Z的分子中的氢原子被氯原子所取代,它的一氯取代物有几种 。 ⑺ 用分子式写出反应③的化学方程式 。 29.(15分)硅单质及其化合物应用范围很广。 (1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅: Ⅰ.高温下用碳还原二氧化硅制得粗硅 Ⅱ.粗硅与干燥的氯气在450 ℃~500 ℃ 反应制得SiCl4 Ⅲ. SiCl4液体经精馏提纯后与过量H2在1100 ℃~1200 ℃ 反应制得纯硅 已知SiCl4沸点为57.6 ℃,能与H2O强烈反应。1 mol H2与SiCl4气体完全反应吸收的热量为120.2 kJ。请回答下列问题: ① 第Ⅰ步制备粗硅的化学反应方程式为 ,第Ⅲ步反应的热化学方程式是 。 ②整个制备纯硅过程必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是 ;H2还原SiCl4过程中若混O2,可能引起的后果是 。
 22、(1)AC(6分)(2)①水果电池的内阻太大(4分) 22、(1)AC(6分)(2)①水果电池的内阻太大(4分)
②a 、B、D ……(4分)b如图……(4分) 23.解:对飞鸟,设其最小的飞行速度为v1,则: 对飞机,设其最小起飞速度为v2, 则: 两式相比得: 设飞机在跑道上滑行的距离为s,由公式:v2=2as (4分) 得: 24、(1)小球运动至第一次碰前: mgh=mv02/2…………………………………………… eq \o\ac(○,1)1 2’ 碰撞过程,动量守恒: mv0=(M+m)v1………………………………………… eq \o\ac(○,2)2 2’ 碰后压缩弹簧过程中,M、m及弹簧系统机械能守恒: Epm=(M+m)v12/2…………………………………… eq \o\ac(○,3)3 2’ 由 eq \o\ac(○,1)1、 eq \o\ac(○,2)2、 eq \o\ac(○,3)3联立解得: Epm= (2)第一次碰后小球向BC轨道运动的初速度即为v1,由机械能守恒得:
由 eq \o\ac(○,1)1、 eq \o\ac(○,2)2、 eq \o\ac(○,5)5联立解得: (3)小球在BC段运动可等效为单摆,其周期为: T= 分析得小球第三次通过B点历时为: t= 由 eq \o\ac(○,7)7 eq \o\ac(○,8)8联立解得:t= 25、(1)粒子在电场中做类平抛运动
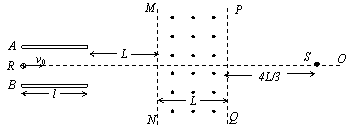
竖直方向的速度 代入数据,解得: vy=1.5×106m/s (1分) 所以粒子从电场中飞出时沿电场方向的速度为:
(2)设粒子从电场中飞出时的侧向位移为h, 穿过界面PS时偏离中心线OR的距离为y,则: h=at2/2 (1分) 即: 代入数据,解得: h=0.03m=3cm (1分) 带电粒子在离开电场后将做匀速直线运动,由相似三角形知识得:
代入数据,解得: y=0.12m=12cm (1分) (3)设粒子从电场中飞出时的速度方向与水平方向的夹角为θ,则:
轨迹如图所示 (3分)
由几何知识可得粒子在磁场中做匀速圆周运动的半径: 由: 代入数据,解得: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |