|
化学试卷
(试卷满分为100分,考试时间为100分钟)
可能用到的相对原子质量: H—1 C—12 N—14 O—16 Na—23 S—32 Cl—35.5
K—39 Cu—64 Zn—65 Ba—137
第Ⅰ卷(选择题 填涂在机读卡上)
一、选择题(每小题只有1个选项符合题意,每小题2分,共46分)
1.通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,能加快化学反应速率的是( )
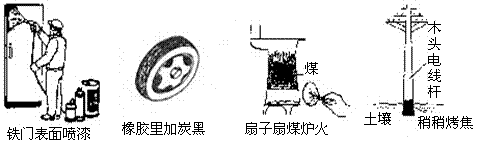
A. B. C. D.
2.下列关于能源和作为能源物质的叙述中错误的是( )
A.人类利用的能源都是通过化学反应获得的
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转为热能、电能为人类所利用
D.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能
3.在短周期元素中,属于非金属(包括稀有气体)元素的有( )
A.9种 B.10种 C.12种 D.13种
4.对化学反应速率与化学反应限度的叙述,不正确的是( )
A.任何可逆反应都有反应限度
B.反应温度是影响化学反应速率的决定性因素
C.化学反应的限度影响了反应物在该条件下的最大转化率
D.同一化学反应若反应条件不同限度可能不同
5.有一种医用核素在医学临床诊断中应用很广。门捷列夫在建立元素周期律的时候,曾经预言了它的存在,命名它为类锰。莫斯莱确定了它的原子序数为43。现在这种元素的单质是从核燃料的裂变产物中提取的,单质抗氧化能力强,在酸中溶解度不大。已知这种核素的中子数比质子数多13。那么这种医用核素可能是( )
A. 56Mn B.56Tc C. 99Mn D.99Tc
6.光照对下列反应几乎没有影响的是( )
A.氯气和氢气反应 B.氯气跟甲烷反应 C.甲烷跟氧气反应 D.次氯酸分解
7.由乙烯推测丙烯(CH2=CH-CH3)的结构和性质,正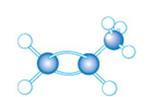 确的是( ) 确的是( )
A.与HCl发生加成反应仅得一种产物
B.丙烯的结构模型是
C.不能使酸性KMnO4溶液褪色
D.不能使溴水褪色
8.下列关于物质性质变化的比较,不正确的是( )
A.酸性强弱:HIO4>HBrO4>HClO4 B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH D.金属性强弱:Na>Mg>Al
9.根据原子结构示意图的共同特征,可以把 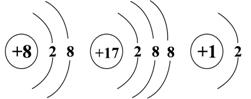 三种微粒归纳为一类,下列微粒中可以归入此类的微粒是( ) 三种微粒归纳为一类,下列微粒中可以归入此类的微粒是( )
A.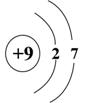 B. B.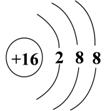 C. C.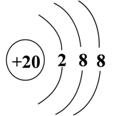 D. D.
10.甲、乙是周期表中同一主族的两种元素,若甲的原子序数是x,则乙的原子序数不可能是( )
A.x+2 B.x+4 C.x+8 D.x+18
11.对于反应2HI(g) H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是( ) H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是( )
A.混合气体的颜色不再变化
B.温度和体积一定时,容器内压强不再变化
C.1molH-H键生成的同时有2molH-I键断裂
D.各物质的物质的量浓度之比为2:1:1
12.直接提供电能的反应一般是放热反应,下列反应中能提供电能的是( )
A.Ba(OH)2·8H2O与NH4Cl反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与CO2反应 D.H2与Cl2燃烧反应
13.用铁片和稀硫酸制取氢气,下列措施不能使氢气的生成速率加快的是( )
A.加热 B.将稀硫酸改为98%的浓硫酸
C.滴加少量的硫酸铜溶液 D.将铁片改为铁粉
14.下列叙述是某同学做完铜锌原电池的实验后得出的结论和认识,你认为正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作为电极与硫酸铜溶液组成的原电池中,铜是负极
C.电子沿导线由锌流向铜,进入硫酸溶液被氢离子得到而放出氢气
D.铜、锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过
15.X、Y为短周期元素,X的原子半径小于Y。则下列叙述正确的是( )
A.原子序数Y大于X
B.X元素的最高正价一定大于Y元素的最高正价
C.若X元素形成的单质是X2,Y元素的单质一定是Y2
D.若X、Y原子电子层数相同,Y的失电子能力一定强于X
16.甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物:
⑴CH3Cl ⑵CH2Cl2 ⑶CHCl3 ⑷CCl4 其中正确的是( )
A.只有⑴ B.只有⑶ C.⑴⑵⑶的混合物 D.⑴⑵⑶⑷的混合物
现有a—h 8种短周期元素,它们在周期表中的位置如下,并据此回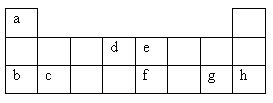 答下列17、18两题 答下列17、18两题
17.下列元素的原子间反应最容易形成离子键的是( )
A.c和f
B.b和g
C.d和g
D.b和h
18.下列由a—h形成的各分子中所有原子都满足最外层为8电子结构的是( )
A.ea3 B.ag C.dg4 D.fg5
19.下列各组物质中,互为同分异构体的是( )
A. 和 和 
B.  和 和 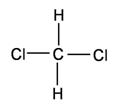
C.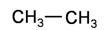 和 和 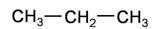
D.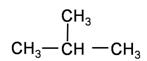 和 和 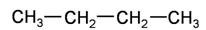
20.已知在298 K,101kPa的条件下,1molH2的共价键断裂吸收akJ能量,1molO2的共价键断裂吸收bkJ能量,形成1molH2O的共价键(含2molH—O)释放ckJ能量。根据上述数据计算1mol氢气完全燃烧释放出的能量( )
A.c-a-b B.a+b-c C.c-a-0.5b D.a+0.5-b
21.硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒可能具有的性质为( )
A.单质硒在通常状况下是气体 B.SeO3的水化物呈碱性
C.H2Se比H2S稳定 D.硒元素有+4、+6、-2三种常见价态
22.反应4NH3(g )+5O2(g )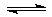 4NO(g )+6H2O(g )在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率可表示为( ) 4NO(g )+6H2O(g )在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率可表示为( )
A.υ(NH3)=0.01mol/(L s) B.υ(O2)=0.001mol/(L s)
C.υ(NO)=0.001mol/(L s) D.υ(H2O)=0.045mol/(L s)
23.已知一定温度时: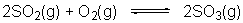 。 。
当生成2molSO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是( )
A.Q=197 kJ B.Q<197×2 kJ C.Q<197 kJ D.Q>197 kJ
第Ⅱ卷(填写在答题纸上) 二、填空题(共54分)
24.有A、B、C、D、E五种短周期元素,其中A、B、C三元素在元素周期表中的位置如图所示,已知A、C两种元素的质子数之和等于B的质子数,B、D、E属于同一周期,D元素原子的最外层只有一个电子,E元素的质子比D元素的质子数多两个。据此填空:
(1)A在元素周期表中位于第________________周期第________________族,
B元素的原子结构示意图为________________,
A、B、C、D、E的单质中,氧化性最强的是(写化学式)________________。
(2)A的氢化物的结构式为____________,属于____________(填“共价”或“离子”)化合物。
(3)C的氢化物的电子式为__________,由电子式表示D和B所形成的化合物的过程_________。
(4)E的氧化物与D的最高价氧化物对应的水化物反应的离子方程式为________________。
25.CH4是天然气、沼气的主要成分,目前世界20%的能源需求由它提供。
(1)写出CH4结构式________________。
(2)CH4是重要的化工原料,可以制备重要溶剂四氯化碳,写出由CH4直接生成四氯化碳的化学方程式
________________。
(3)写出CH4燃烧的化学方程式________________。农村富有秸秆、杂草等废弃物,它们的主要成分可以用(C6H10O5)n来表示,已知:(C6H10O5)n+nH2O 3nCO2+3nCH4;此反应为放热反应。请说出这个反应的实际价值与意义________________。 3nCO2+3nCH4;此反应为放热反应。请说出这个反应的实际价值与意义________________。
(4)CH4还用于燃料电池,电池的电解质溶液是强碱溶液。
下列关于CH4的燃料电池说法中正确的为________________。
A.正极反应:O2+2H2O+4e-=4OH- B.负极反应:CH4+10OH--8e-=CO32-+7H2O
C.工作一段时间后,电解液中KOH的物质的量不变
D.放电时溶液中的OH-离子向负极移动
26.将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:

已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据表中数据判断:
(1)________金属可能是最强的还原剂;________金属一定不能从硫酸铜溶液 中置换出铜。 中置换出铜。
(2)根据反应:2FeCl3 + Cu = 2FeCl2 + CuCl2选择适宜的材料和试剂设计一个原电池,以“ ” 代表反应容器,“ ” 代表反应容器,“ ” 代表导线,“ ” 代表导线,“ ” 代表电极, “ ” 代表电极, “ ”代表小灯泡,在右侧方框内画出装置图并指出电极材料和电解质溶液。 ”代表小灯泡,在右侧方框内画出装置图并指出电极材料和电解质溶液。
27.某学生小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响;
(Ⅱ)实验①和_________探究温度对该反应速率的影响;
(Ⅲ)实验①和__________探究大理石规格(粗、细)对该反应速率的影响。 |
| ② |
|
|
|
| ③ |
|
|
|
| ④ |
|
|
|
(2)实验①中CO2质量随时间变化的关系见下图:
依据反应方程式 CaCO3+HNO3= CaCO3+HNO3= Ca(NO3)2+ Ca(NO3)2+ CO2↑+ CO2↑+ H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。 H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。

重点解析:
1.木材经火烧处理后生成炭化层,炭性质稳定微生物无法利用
12.提供电能的反应应属于氧化——还原反应
14.电子不能进入溶液
15.同周期原子半径从左到右由大到小,同主族元素原子半径从上至下由小到大
18.ea3(NH3)H不满足要求 ag(HCl)H不满足要求dg4(CCl4) fg5(PCl5)P超过8电子
19.注意建立空间立体结构
22.注意时间单位要统一
23.当2molSO2和1molO2完全转化成2molSO3时,放出热量197kJ,本题由于要建立化学平衡状态,在反应达到化学平衡状态时,生成的SO3小于2mol,因此放出的热量小于197kJ。
参考答案:
1.C 2.A 3.D 4.B 5.D 6.C 7.B 8.A
9.B 10.B 11.A 12.D 13.B 14.D 15.D 16.D
17.B 18.C 19.D 20.C 21.D 22.C 23.C
24.
(1)第二周期、VA族。原子结构示意图:略 F2
(2)结构式:略 共价
(3)电子式:略
(4)2OH-+Al2O3==2AlO2-+H2O
25.
(1)略
(2)CH4+4Cl2→CCl4+4HCl 条件:光照
(3) CH4+ 2O2==CO2+2H2O 条件:点燃
(4)ABD
26.
(1) D,B (2)略
27.
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
⑴实验①和②探究HNO3浓度对该反应速率的影响;
⑵实验①和③探究温度对该反应速率的影响。
⑶实验①和④探究大理石规格(粗、细)对该反应的影响。 |
| ② |
298 |
粗颗粒 |
1.00 |
| ③ |
308 |
粗颗粒 |
2.00 |
| ④ |
298 |
细颗粒 |
2.00 | (2)①70至90S,CO2生成的质量为:m(CO2)0.95-0.85=0.1g
②根据方程式比例,可知消耗HNO3的物质的量为:n(HNO3)0.1/22=1/220mol
③溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=2/11 mol/L
④反应的时间t=90-70=20s
⑤所以HNO3在70-90S范围内的平均反应速率为
v(HNO3)=△c(HNO3)/t == 1/110 mol·L-1·S-1
|