| |
|
[组图]质量守恒定律周练习
|
| 查询化九年上练习的详细结果
|
|
一、选择题
1.下列各项:①原子的数目;②分子的数目;③元素的种类;④物质的种类;⑤物质的分子个数;⑥各种原子的总数;⑦物质的质量。在化学反应前后,肯定没有变化的是( )
A.①③⑥⑦ B.①⑥ C.②③⑤ D.①③⑥
2.在A+B=C+D的反应中,5克A和一定的B恰好完全反应,生成3克C和9克D,则B的质量是( )
A. 18克 B.7克 C.8克 D.6克
3.现将10 gA和足量的B混合加热,A和B充分发生化学反应。10 gA完全反应后生成8 gC和4gD,则参加反应的A与B的质量比是 ( )
A.1∶l B.2∶1 C.5∶l D.4∶l
4.充分加热a克氯酸钾与b克二氧化锰的混合物,留下残余固体c克,生成O2的质量为( )
A.(a-b)克 B.(a-b-c)克 C.(a+b-c)克 D.(a-b+c)克
5.发射“嫦娥一号”的长三甲火箭燃料是偏二甲肼(X),氧化剂是四氧化二氮(N2O4),反应的化学方程式为:X+2N2O4=3N2+2CO2+4H2O,X的化学式为 ( )
A.H2 B.CH4 C.C2H8N D.C2H8N2
6.下列各组物质,在敞口容器里发生反应,容器内物质的总质量在反应前后不变的是( )
A.镁条放入盐酸中 B.高锰酸钾固体受热分解
C.硫酸铜溶液中加入氢氧化钠溶液 D.在空气中加热白磷
7.下列四个反应的生成物都是C,如果C的化学式为A2B5,则该反应的化学方程式为( )
A. 2AB2 + B2 == 2C B. 3AB2 + B2 == 2C
C. 4AB2 + B2 == 2C D. AB2 + 4B2 == 2C
8.在化学反应:M+N=P+Q中,a g M和b g N恰好完全反应,生成c g P。则生成Q的质量为( )
A.(b+c-a) g B.(a-c+b) g C.(a+c-b) g D.(c-a+b) g
9.A、B、C三种物质各15 g,它们化合时只能生成30 g新物质D。若增加10 g A,则反应停止后,原反应物中只余C。根据上述条件推断下列说法中正确的是
A.第一次反应停止后,B剩余9 g B.第二次反应后,D的质量为40 g
C.反应中A和B的质量比是3∶2 D.反应中A和C的质量比是5∶2
10.下列能用质量守恒定律解释的是( )
A.湿衣服晾干后质量减小
B.蜡烛受热熔化,冷却后质量不变
C.纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
D.10 g蔗糖溶于90 g水中,得到质量为100 g的糖水
11.已知反应3A+2B==2C+D,A、B两种物质完全反应时质量比为3׃4,若生成C和D共140克,则该反应消耗B的质量为( )
A. 60克 B.80克 C.90克 D.120克
12.一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得数据见下表。下列说法中正确的是( )
| 物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前质量 |
8g |
35g |
5g |
8g |
| 反应后质量 |
2g |
X |
5g |
42g | A.X=7g B.在该反应中,丙物质一定做催化剂
C.该反应是分解反应 D.在该反应的化学方程式中,丙、丁的化学计量数之比为1∶l
13.在反应 2A+5B=2C+4D 中,C、D 的相对分子质量之比为 9:22。若 2.6 gA与 B完全反应后,生成 8.8gD。则在此反应中,B与D的质量比为
A.4:9 B.8:11 C.10:11 D.31:44
14.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:
| 物 质 |
a |
b |
c |
d |
| 反应前质量(g) |
6.4 |
3.2 |
4.0 |
0.5 |
| 反应后质量(g) |
待测 |
2.56 |
7.2 |
0.5 | 下列说法中错误的是
A.a和b是反应物,d可能是催化剂
B.反应后a物质的质量为4.64g
C.c物质中元素的种类,一定等于a、b二种物质中元素的种类
D.若物质a与物质b的相对分子质量之比为2:1,则反应中a与b的化学计量数之比为2:1
15.“绿色奥运”是2008年北京奥运会的主题之一。为减轻大气污染,在汽车尾气排放口加装“三效催化净化器”,在不消耗其它物质的情况下,可将尾气中的CO、NO转化为参与大气循环的无毒混合气体。试推测,该无毒混合气体是
A.N2和CO2 B.CO2和NO2 C.CO2和O2 D.CO2和SO2
二、实验题
16.小明和小华进行盐酸与锌反应制取氢气的实验研究。小明用较稀的盐酸,小华用较浓的盐酸。他们分别取等质量的锌粒与足量盐酸在烧杯中反应,并将烧杯中物质总质量随反应时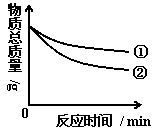 间的变化情况绘制成如图。 间的变化情况绘制成如图。
试回答下列问题:
(1)烧杯中物质总质量减少的原因是________________________。
(2)表示小明实验结果的是图中的曲线__________(填①和②)。
(3)请说明图中的曲线②与曲线①不同的原因__________________。
17.
(1)某同学按下图装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,该反应符合质量守恒定律(填“符合”或“不符合”),理由是____________。
(2)由质量守恒定律可知,化学反应前后,一定不变的是 ____________ (填 序号)。 序号)。
①原子种类 ②原子数目 ③分子种类
④分子数目 ⑤元素种类 ⑥物质种类
(3)硝酸在工业生产中且有广泛的应用.工业上制取硝酸的关键反应为:
 ,其中R的化学式为____________。 ,其中R的化学式为____________。
18.早在17世纪,质量守恒定律被发现之前,英国化学家波义耳曾做过一个实验:在密闭的玻璃容器中燃烧金属时,得到了金属灰,然后打开容器,称量金属灰的质量,发现比原金属质量增加了。
(1)试解释金属灰质量比原金属质量增加的原因。
(2)由于波义耳称量方法上的原因,他错过了发现质量守恒定律的机会。请你改进他的称量方法,以验证质量守恒定律。
参考答案:
一、选择题
| 题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| 答案 |
D |
B |
C |
C |
D |
C |
C |
B |
| 题号 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
| 答案 |
D |
C |
B |
A |
C |
B |
A |
|
二、实验题
16.
解析:要求根据所用试剂的性质进行深入分析探究。
Zn+2HCl=ZnCl2+H2↑,反应放出氢气,所以烧杯中物质总质量减少;另外,盐酸具有挥发性,反应放出的热量会加速盐酸的挥发,浓盐酸具有强烈的挥发性,若使用浓盐酸,挥发出的氯化氢气体较多,使得烧杯中剩余物质质量更少。
答案:
(1)产生的氢气逸散到空气中;盐酸挥发出氯化氢气体;
(2)①;
(3)浓盐酸更易挥发,导致减少质量更多。
17.
(1)反应生成的CO2气体逸出,导致天平不平衡(2) ①②⑤(3)H2O
18.
解析:该题是以波义耳的一次实验失误为背景设计的,要求经过分析提出自己的设计方案。
(1)金属燃烧是金属与氧气发生化合反应,生成金属氧化物。根据质量守恒定律可知,参加反应的金属与氧气的质量之和等于生成的金属氧化物的质量。生成的金属灰是金属氧化物,所以金属灰的质量比原金属的质量增加了。
(2)由于金属在燃烧时会结合空气中的氧气,波义耳在燃烧后打开容器盖进行称量,使外界空气进入容器,所以反应后的质量增加了,因此导致波义耳未能发现质量守恒定律。可改进为:分别称量反应前后密闭容器中物质的质量。
|
来源:中国哲士网
教师学生家长 化九年上练习资料 备课考试教学
教育资料 [组图]质量守恒定律周练习 文章
|
| 上一篇文章: 利用化学方程式的简单计算 |
| 下一篇文章: 质量守恒定律、如何正确书写化学方程式 |
| |
|
|