| |
|
[组图]金属材料和金属的化学性质
|
| 查询化九年上练习的详细结果
|
|
1.金属材料在人类活动中已得到越来越广泛的应用。下列属于金属共性的是
A.很高的熔点 B.良好的导电性 C.很大的硬度 D.银白色的光泽
2.元素在自然界里分布并不均匀,如智利富藏铜矿,澳大利亚多铁矿,山东的黄金储量居我国首位,但从整个的地壳含量的多少分析,最丰富的金属元素是
A.Fe B.Si C.O D.Al
3.根据下列原子结构示意图判断,属于金属元素的是
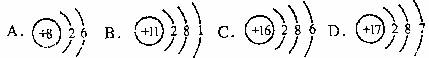
4.不可用来盛放硫酸铜溶液的容器是
A.铜制容器 B.瓷制容器 C.铁制容器 D.玻璃容器
5.不法分子常用金光闪闪的“假元宝”(铜锌合金,呈金黄色)蒙骗人们。下列鉴别方法中错误的
A.加盐酸 B.测密度 C.加硝酸银溶液 D.看颜色
6.随着社会的发展,废旧家用电器越来越多。因废旧家用电器里的电路板张含有Al、Fe、Cu、Ag、Au(金)等多种贵重金属,使回收废旧电路板中的贵重金属成为一种新的行业。在回收贵重金属的过程中,如把废旧电路板放入足量的盐酸中充分反应,然后过滤,剩余的固体不应该有的金属是
A.Al B.Au(金) C.Cu D.Ag
7.在铁的某种氧化物中,铁元素和氧元素的质量之比为7︰3,则该氧化物中铁原子和氧原子的个数之比为
A.1︰1 B.2︰3 C.3︰2 D.3︰4
8.某学生为了验证铁、锌、铜三种金属的活动性顺序,设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中②将Zn、Cu分别加入到ZnSO4溶液中③将Zn分别加入到FeSO4、CuSO4溶液中④将Fe 分别加入到ZnSO4、CuSO4溶液中
A.①或④ B.①或② C.②或③ D.③或④
9.在CuCl2和MgCl2的混合液中,加入过量的锌粉充分反应后,过滤留在滤纸上的物质是
A.Zn B.Cu C.Cu和Mg D.Zn和Cu
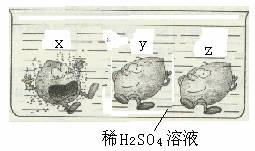
10.如图所示是X 、Y、Z三种金属在容器中的 反应现象,下列说法正确的是
A.X 、Y、Z三种金属均发生了置换反应
B.三种金属的活动性顺序是X>Y>Z
C.若Z能从金属Y的盐溶液里置换出Y,则三种金属的活动性顺序是X>Z>Y
D.若X为金属镁,则Z可能是铁
11.将一定量铝粉和氧化铜混合加热,反应的化学方程式为3CuO+2Al 3Cu+A12O3 。反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中。下列叙述的现象中,能够说明氧化铜没有完全反应的是 3Cu+A12O3 。反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中。下列叙述的现象中,能够说明氧化铜没有完全反应的是
①加入稀硫酸后,有气泡生成
②加入稀硫酸后,没有气泡生成
⑧加入稀硫酸后,溶液中有红色不溶物质
④插入溶液中的铁片表面有红色物质析出
A.只有④ B.②③ C.③④ D.①③④
12.向一定量的铁粉中逐滴加入稀硫酸至过量,下图是反应过程中某种物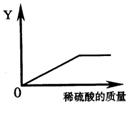 质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示 质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示
A.消耗铁粉的质量
B.生成硫酸亚铁的质量
C.溶液的总质量
D生成氢气的质量
13.对甲、乙、丙三种金属活动性的实验研究过程如下:(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,甲、丙表面出现红色物质,乙没有现象。(2)取大小相等的甲、丙两种金属片,分别放入相同的稀盐酸中,甲、丙表面都产生气泡,但甲产生气泡的速度明显比丙的快。则甲、乙、丙三种金属的活动性顺序是
A.甲〉丙〉乙 B.丙〉乙〉甲 C. 甲〉乙〉丙 D . 丙〉甲〉乙
14.X、Y、Z、W是四种不同的金属,为比较金属活动性的强弱,某同学利用这四种金属单质、盐酸、Z的硝酸盐、W的硝酸盐,进行有关实验,结果如下表(能发生置换反应的记为“√”,不能反应的记为“一”,无标记的表示未做该实验)。这四种金属的活动性顺序为( )
A.X〉W〉Y〉Z B.X〉Y〉W〉Z
C.W〉X〉Y〉Z D.Y〉W〉Z〉X
| |
X |
Y |
Z |
W |
| 盐酸 |
√ |
— |
— |
√ |
| Z的硝酸盐 |
|
√ |
|
|
| W的硝酸盐 |
√ |
|
— |
|
15.根据如图所示关系回答问题
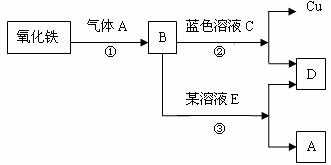
(1)写出上图各物质化学式
A__________B_________C____________D_________E_________
(2)写出①反应的化学方程式____________________________
16.人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝。
(1)金属大规模被使用的先后顺序跟_____________(填序号)选项关系最大。
①地壳中金属元素的含量;②金属的导电性;③金属的活动性。
(2)为探究锰与铁的金属活动性,在相同温度下,取大小相同、表面光亮的两种金属薄片,分别投入等体积、等溶质质量分数的足量稀盐酸中(反应中Mn显+2价),请回答:
| 金属 |
铁 |
锰 |
| 与盐酸反应现象 |
放出气泡速率缓慢 |
放出气泡速率较快 |
| 结论 |
活动性铁__________(填“>”“<”)锰 | 除了比较与酸反应产生气体速率的快慢,请你再举出一种可比较这二种金属活动性强弱的方法(写出所需药品即可):_____________和_______________。
(3)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的镁和铁,待反应停止后,请判断:
①若天平仍保持平衡,烧杯中一定没有剩余的物质是____________;
②若天平失去平衡,则指针一定偏向放_____________的一边。
17.置换反应是化学反应的基本类型之一。
(1)金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来,如铜和硝酸银溶液反应,其化学方程式为 。
(2)非金属单质也具有类似金属与盐溶液之间的置换反应规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:
C12+2NaBr=2NaCl+Br2 ;I2+Na2S=2NaI+S↓+Br2;Br2+2KI=2KBr+I2
由此可判断:
①S、C12、I2、Br2活动性由强到弱顺序是 。
②下列化学方程式书写错误的是 。
(A)C12+2NaI=2NaCl+I2 (B)I2+2KBr=2KI+Br2
(C)Br2+Na2S=2NaBr+S↓ (D)C12+K2S==2KCl+S↓
参考答案
1.B 2.D 3.B 4.C 5.D 6.C 7.B 8.A 9.D 10.C
11.D 12.C 13.A 14.A
15.(1) A:H2 B:Fe C:CuSO4 (或CuCl2)
D:FeSO4(或FeCl2) E:H2SO4(或HCl)
(2) 3H2+Fe2O3 2Fe+3H2O 2Fe+3H2O
16.(1)③ (2)< 金属锰的薄片 氯化亚铁溶液 (3)盐酸 铁
17.(1)Cu+2AgNO3== Cu(NO3)2+2Ag (2)①C12〉Br2〉I2〉S ②B
|
来源:中国哲士网
教师学生家长 化九年上练习资料 备课考试教学
教育资料 [组图]金属材料和金属的化学性质 文章
|
| 上一篇文章: 溶液的形成 饱和溶液和不饱和溶液 |
| 下一篇文章: 溶解度 溶质的质量分数 |
| |
|
|