|
[试题]
1.在抢救大出血的危症病人时,常需静脉点滴输予0.9%的氯化钠溶液(俗称“生理盐水”)是由于人体血液的“矿化度”(即无机盐的相对含量)为0.9%。另有研究表明,30亿年前地表原始海水的矿化度即为0.9%。对此,下列猜测或评论中,不足取的是()
A.人类祖先可能是从原始海洋中逐渐进化到陆地上的
B.人体血液和原始海水的矿化度均为0.9%纯属巧合
C.人体血液和原始海水之间存在着某些尚未被认识的关系
D.人体血液仍然带有原始海水的某些印痕
2.当调整、改变有关反应物的相对用量时,下列反应的产物不会改变的是()
A.硫在氧气中燃烧 B.CO2通入石灰水中
C.木炭在氧气中燃烧 D.氨气通入磷酸溶液中
3.实验测知,久贮的某NaOH固体中水的质量分数为3.5%,Na2CO3的质量分数为6.5%。若取质量为a的此样品加入到含HCl质量为b的稀盐酸(过量)中,完全反应后再加人含NaOH质量为c的NaOH溶液,恰好完全中和残余的盐酸,则所得溶液蒸干时得到的晶体质量可能为()
A.1.3a B.1.6b C.1.32a+1.46c D.1.39a+1.46c
4.由Na、S、O、H中的2种或3种元素组成4种化合物。甲能跟BaCl2反应生成另外两种盐;乙能跟NaOH反应生成盐和水;丙能跟HCl反应生成盐和水;丁呈中性,跟CaO或CO2化合生成碱或酸。则下列判断错误的是( )
A.甲可能是Na2SO4 B.乙一定是H2SO4 C.丙可能是NaOH D.丁一定是H2O
5.在一定质量的硫酸溶液中加入氯化钡溶液直到反应完全,产生沉淀的质量与原硫酸溶液的质量相等,则原硫酸溶液中H2SO4的质量分数为( )
A.42% B.36% C.30% D. 24%
[答案]1.B 2.A 3.BD 4.B 5.A
初中化学竞赛试题选萃(九)
[试题]
1.由碳、氢元素组成的某气态有机物,当其在氧气中完全燃烧生成44.0 g CO2和13.5 g H2O时,所消耗的该气态有机物的质量是_________。
假设该有机物的相对分子质量是54,则其化学式为___________。
2.在高温条件下,金属镁能跟多种气态物质发生反应。例如,
3Mg+N2 Mg3N2(固体,热稳定性好) 2Mg+CO2 Mg3N2(固体,热稳定性好) 2Mg+CO2 2MgO+C 2MgO+C
若以相同质量的镁(条)在①O2、②N2、③CO2、④空气中分别充分燃烧均能得到固体产物,则按固体产物质量由大到小所对应的气体分别是(填气体序号)_________________。
3.某化合物完全燃烧消耗氧气9.6 g,生成8.8 g二氧化碳和5.4 g水,则组成该化合物的元素是________________。
4.用化学方法除去下列物质中的杂质,写出有关化学方程式并标明基本反应类型。
(1)铜粉中混有少量铁粉_________________,_______________。
(2)二氧化锰中有少量木炭粉______________,______________。
(3)硫酸钠中混有少量碳酸钠______________,______________。
(4)硝酸钠中混有少量硫酸钠______________,______________。
[答案]1.13.5 g;C4H6
2.③、①、④、②
3.C、H、O
4.(1)Fe+H2SO4(稀)==FeSO4+H2↑或Fe+2HCl==FeCl2+H2↑置换反应
(2)C+O2==CO2化合反应
(3)Na2CO3+H2SO4==Na2SO4+CO2↑+H2O 复分解反应
(4)Na2SO4+Ba(NO3)2==BaSO4↓+2NaNO3 复分解反应
初中化学竞赛试题选萃(十)
[试题]
1.1989年世界卫生组织确认,长期或大量摄入铝元素对人体的大脑和神经系统将造成损害,建议限制能导致人体摄入铝元素的各种应用。根据你的生活经验,这些受限制的应用可能包括:
(1)________________________________________________________
(2)________________________________________________________
(3)________________________________________________________
2.为了降低城乡居民因食物和饮用水中含碘量不足而导致碘缺乏症的发病率,我国已执行食盐加碘的法规,制定了“碘盐”的国家标准。市售二级碘盐的商品包装上标明“配料:食盐、碘酸钾;氯化钠含量:94%;含碘量: 30 mg/kg”。
(1)碘酸钾是碘元素(符号I)呈+5价的含氧酸的钾盐(不含结晶水),其化学式是_________________________。
(2)在市售的二级碘盐中,碘酸钾的质量分数为______________;用1 kg碘酸钾可生产碘盐_______t。
(3)制造碘盐并不直接使用碘(单质)而是使用碘酸钾,主要原因可能是(选填下列列举原因的序号)_________________。
A.碘酸钾的价格较低,有利于减轻居民食用碘盐的经济负担
B.碘酸钾较易溶解于水,有利于碘盐生产操作和食用吸收
C.碘酸钾热稳定性优于碘,有利于碘盐生产、贮放、使用过程中减少碘的损失
[答案]
1.(1)铝制炊具和食品、饮料的包装材料
(2)用Al(OH)3制备治疗胃酸过多的药物
(3)用KAl(SO4)2(明矾)净水或作油炸食品的添加剂
2.(1)KIO3(2)5.06×10-5 19.8(3)B、C
初中化学竞赛试题选萃(十一)
[试题]
1.现对CO2和CO混合气体进行间歇性分离及干燥的实验装置设计如下图。
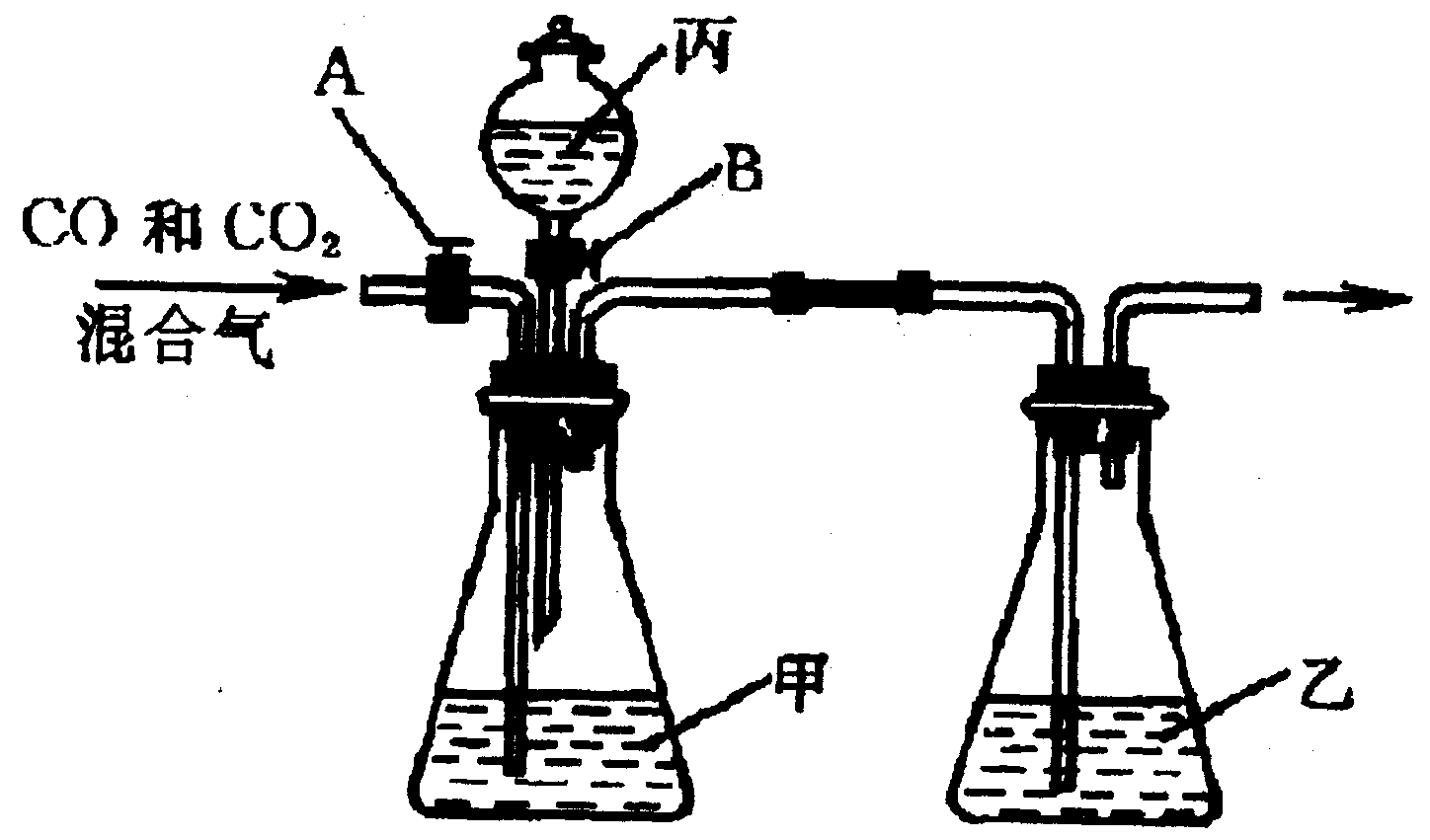
其中仪器丙为分液漏斗,其颈上有活塞B。通过开启、部分开启或关闭B可以控制漏斗内的液体滴入甲瓶的速率。进入甲瓶的导气管上有活塞A,其功能与B相似。试回答此实验的有关问题:
(1)试剂选择
为了达到实验目的,甲、乙、丙中均需分别加入适当的液体(可供选择的有:水、NaOH溶液、NaCl溶液、Na2CO3溶液、饱和石灰水、浓硫酸、稀硫酸、稀硝酸、浓盐酸)。其中,甲应选________,乙应选________,丙应选____________。
(2)操作程序
当与甲装置连接的两个活塞分别处于___________状态时,导人混合气可先分离得到干燥的___________气体;然后当两个活塞分别变为_________状态时,可分离得到干燥的_______气体,此时甲瓶内出现的现象是_______。
(3)装置评价
如需全部收集从混合气分离所得的CO2和CO,此套装置最主要的缺点是______________,主要原因是________________________。
2.现有一包氯化钠固体,其中混有少量硫酸钠和氯化镁,可通过以下实验除去杂质得到纯净的氯化钠,请将正确合理的操作顺序填人括号中。并简要回答(1)~(3)题。
( )在溶液中加入稍过量的Na2CO3溶液,然后过滤
( )加入稍过量的BaCl2溶液,然后过滤
( )将混有杂质的氯化钠完全溶解于水
( )在滤液中加入稀盐酸至溶液的pH等于7
( )蒸发结晶
( )在滤液中加人稍过量的NaOH溶液,然后过滤
(1)为什么要加入稍过量的Na2CO3溶液?
__________________________________________________
(2)为什么要加入稀盐酸至溶液的pH等于7?
___________________________________________________
(3)写出上述两步骤中有关的化学方程式。
_____________________,__________________,________________。
[答案]1.(1)NaOH溶液浓硫酸稀硫酸
(2)A开、B关CO
A关、B开CO2
有大量气泡产生
(3)经分离收集到的CO2、CO均不够纯净
装置内的空气和间歇转换时残留的CO都难于排净
2.
3、2、1、5、6、4(或4、3、1、5、6、2)
(1)为了除去溶液中多余的BaCl2(2)为了除去过量的NaOH和Na2CO3
(3)BaCl2+Na2CO3=BaCO3↓+2NaCl Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaOH+HCl=NaCl+H2O
初中化学竞赛试题选萃(十二)
[试题]
1.酸式碳酸盐和碳酸盐类似,能跟酸起反应产生CO2。当向100 g 25.2%稀硝酸中先后加入固体碳酸氢钠(NaHCO3)和氢氧化钠共20.4 g时,硝酸恰好耗尽;再将所得溶液蒸发掉39.5 g水时,刚好得到10 ℃的饱和溶液。试求:
(1)该饱和溶液中溶质的质量是多少?
(2)所得饱和溶液中的溶质在10 ℃时的溶解度是多少?
2.用下图所示装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:
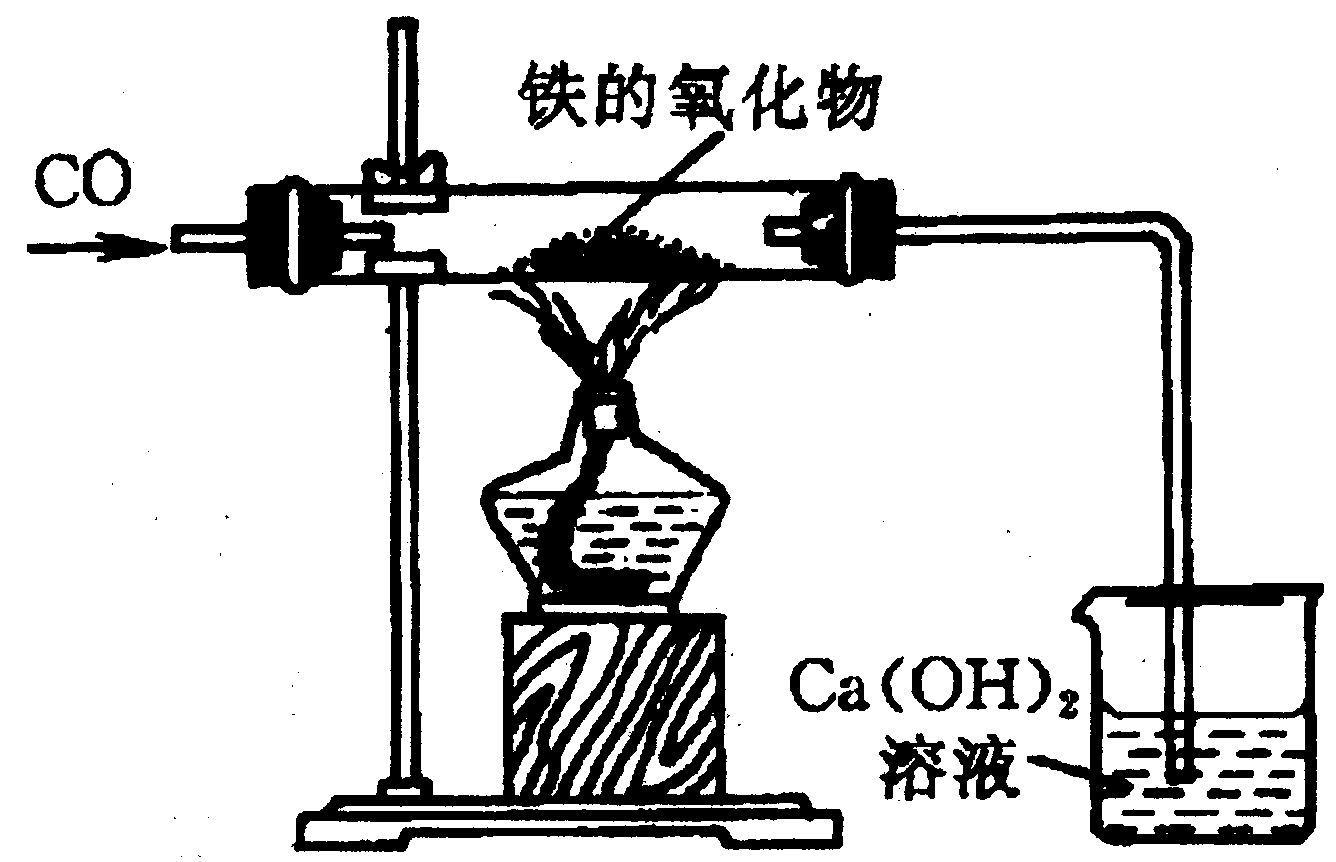
(1)装铁的氧化物的玻璃管质量为20 g;
(2)玻璃管和铁的氧化物质量为23.6 g;
(3)烧杯和澄清石灰水的质量为150 g;
(4)通入一氧化碳并加热,铁的氧化物全部变为铁后,再称盛石灰水的烧杯的质量为152.2 g。
根据上述实验记录,计算此铁的氧化物中铁元素和氧元素的质量比。
[答案]1.34 g;80 g
2.7:2
初中化学竞赛试题选萃(十三)
[试题]
1.某化合物(用X表示其化学式)在催化剂作用下被氧化,反应方程式如下 :
4X+5O2→4NO+6H2O,根据质量守恒定律,确定X为
(A)N2H2 (B)NH2 (C)NH4 (D)NH3
2.元素R在化合物中只有一种化合价,下列化学式有一错误的是
(A)R(OH)2 (B)RC13 (C)R2(SO4)3 (D)R2O3
3.下列混合气体遇火,不可能发生爆炸的是
(A)水煤气和空气 (B)氢气和氧气
(C)甲烷、氮气 (D)碳的粉尘、氧气
4.有液态氢、二氧化碳、盐酸、熟石灰4种物质,它们的用途有:①建筑材料 ,②金属表面除锈,③灭火,④火箭燃料。按上述物质的顺序排列它们相对应的用途。正确的排列是
(A)④③②①(B)③④①②(C)④③①②(D)①②③④(E)④②①③
5.自来水生产过程中,通入氯气的目的是
(A)除去易挥发的杂质 (B)消毒杀菌
(C)沉降泥沙 (D)吸附悬浮物
[答案]1.D 2.A 3.C 4.A 5.B
初中化学竞赛试题选萃(十四)
[试题]
6.某溶液中含有Ba2+、Ag+、Cu2+,现有①NaOH溶液②Na2SO4溶液③盐酸,将三种离子逐一沉淀并加以分离,则加入试剂的顺序正确的是
(A)①②③ (B)③②① (C)②③① (D)②①③
7.国外试行用“汽水”(碳酸饮料)浇灌植物,它的作用是
(A)对植物的呼吸作用有利(B)改良碱性土壤,调节土壤的pH
(C)加速光合作用的进行(D)在植物上方形成温室
8.一辆客车夜晚行驶在公路上,发现油箱泄漏,车厢里充满了汽油的气味,这时应该采取的应急措施是
(A)洒水降温溶解汽油蒸气 (B)开灯查找漏油部位
(C)让车内的人集中到车厢后部 (D)打开所有车窗,严禁一切烟火,疏散乘客
9.下列各组离子在碱性溶液中不可能大量共存的是
(A)Cl-、SO42-、NO3-、CO32- (B)K+、S2-、Cl-、Cu2+
(C)K+、Na+、Ba2+、NO3- (D)H+、Ag+、NO3-、Na+
10.氯仿(CHCl3)不溶于水,密度比水的大,是一种良好的有机溶剂,因保存不当受光照射易被氧化而产生剧毒的光气(COCl2),反应如下:2CHCl3+O2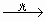 2HCl+2COCl2,则有关氯仿的以下实验操作正确的是 2HCl+2COCl2,则有关氯仿的以下实验操作正确的是
(A)用酚酞试液检查氯仿是否变质 (B)用AgNO3溶液检查氯仿是否变质
(C)用水检查氯仿是否变质 (D)倾倒氯仿进行检验时需在通风橱中进行
[答案]6.B 7.BC 8.D 9.BD 10.BD
初中化学竞赛试题选萃(十五)
[试题]
11.写出下列发生反应的化学方程式,并指出反应类型。
(1)一根铜丝在酒精灯上加热变黑,该反应的化学方程式为:___________反应类型:_______________________
(2)面粉中加入小苏打(NaHCO3),做出来的食物特别疏松可口。请写出小苏打在加工成食物过程中所发生的变化:
化学方程式:______________________
反应类型:_______________________
3)某化工厂用铁屑治理含硫酸汞(有毒)的废水,化学方程式为:_______反应类型:_______________
(4)钡餐透视检查胃病时,病人需服用硫酸钡。若误服碳酸钡就会引起中毒(可溶性钡盐有毒),需立即服用泻盐(硫酸镁)解毒。请写出解毒反应的化学方程式:__________________反应类型:_________________
12.有一包绿色粉末A,进行化学分析如下,将绿色粉末A加热得无色气体B,无色液体C和黑色固体D。(1)将气体B通入澄清石灰水,有白色沉淀E生成;(2)将C滴到无水硫酸铜上,生成蓝色晶体F;(3)将氢气通过D并加热,有红色固体G生成,将稀硫酸加入盛有D的烧杯微热,D溶解,再加NaOH溶液,有蓝色沉淀H生成。根据上述反应现象,推断:A、B、C、D、E、F、G、H各是什么物质,用化学式表示:
A____________B____________C____________D____________
E____________F____________G____________H____________
[答案]11.(1)2Cu+O2  2CuO化合反应 2CuO化合反应
(2)2NaHCO3 Na2CO3+H2O+CO2↑分解反应 Na2CO3+H2O+CO2↑分解反应
(3)Fe+HgSO4==FeSO4+Hg置换反应
(4)BaCl2+MgSO4 BaSO4↓+MgCl2复分解反应 BaSO4↓+MgCl2复分解反应
12. A.Cu2(OH)2CO3 B.CO2 C.H2O D.CuO E.CaCO3 F.CuSO4·5H2O G.Cu(OH)2 H.Cu
|