|
高中阶段教育学校招生统一考试
化 学
一、本卷共14小题,下列各题的四个选项中,只有一个选项是符合题目要求的。每小题2.5分,共35分。
1. 下列现象中,属于物理变化的是
A. 湿衣服晾干 B.钢铁生锈
C.纸张燃烧 D.食物霉变
2. 下图中的化学符号表示2个分子的是
3.CO2和O2是自然界中生命活动不可缺少的两种气体,下列对它们的认识中,正确的是
A. 都含有氧分子 B.都能供动物呼吸
C. 密度都比空气大 D.都不溶于水
4.为保障公民的食品安全,《中华人民共和国食品安全法》于2009年6月1日起正式实施。化学与食品安全密切相关,下列作法中符合食品卫生安全的是
A. 销售过期、变质的食品 B.禁止在食品中添加工业用盐
C.用福尔马林浸泡水产晶 D.销售三聚氰胺含量超标的奶粉
5.结合下表中所列物质的pH判断,在下列各组物质中,分别能使紫色石蕊溶液变红、不变色、变蓝的是
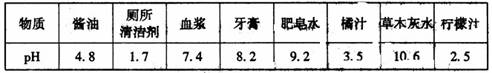
A. 酱油、食盐水、厕所清洁剂 B.牙膏、蒸馏水、肥皂水
C.血浆、蒸馏水、柠檬汁 D.橘汁、食盐水、草木灰水
6.优良环境和充足能源是人类生存和科学发展的基本条件,下列连线前后关系不正确的是
A. 限制生产含磷洗衣粉──减少水质污染
B. 过度排放CO2──形成酸雨
C.发展太阳能产业──开发持久、清洁能源
D.回收各种废弃塑料──防止白色污染
7.甲型H1N1型流感在全世界的蔓延,是对人类健康的重大威胁。从中草药“八角”中提取的莽草酸是生产抗甲型H1N1型流感药物“达菲”的主要原料,莽草酸的化学式为C7H10O5。
下列关于莽草酸的说法中,不正确的是
A. 莽草酸是由碳、氢、氧三种元素组成的
B.莽草酸的相对分子质量为174
C.莽草酸中含有7个碳原子、10个氢原子和5个氧原子
D. 莽草酸在氧气中完全燃烧的生成物是CO2和H2O
8.“分类”是化学学习和研究的重要方法之一,下列分类中不正确的是
A. 硫酸铜、食盐、纯碱──盐
B.硫酸铵、硝酸钾、尿素──氮肥
C.空气、煤气、碘酒──混合物
D.硫元素、氧元素、氦元素──非金属元素
9. 右图是a、b两种固体物质的溶解度曲线,下列有关说法中,正确的是
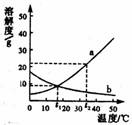
A. a、b两种物质的溶解度都髓温度的升高而增大
B.在t2℃时,b的溶解度比a的溶解度大
C. 在t1℃时,a、b饱和溶液的溶质的质量分数相等
D. 在t2℃时,将20g a加到100g水中,得到的是a的饱和溶液
10.“△△牌洒其玛”是乐山久负盛名的地方特产。其主要生产原料
有:精制面粉、动物油、白糖、鸡蛋、植物油等。下列有关说法中,不正确的是
A. “洒其玛”中不含维生素
B. 动物油和植物油合称为油酯
C.“洒其玛”中含有大量淀粉,淀粉在人体内与水反应变成葡萄糖
D.“洒其玛”中含有丰富的蛋白质,蛋白质是由多种氨基酸构成的
11. 以下是某两种物质在—定条件下发生化学反应的微观示意图:
(“○”和“●”分别表示两种不同元素的原子)
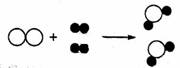
由图可知,下列说法中正确的是
① 该反应属于化合反应 ② 生成物可能是氧化物 ③ 反应遵守质量守恒定律 ④ 反应前后分子和原予种类都不变 ⑤分子在化学变化中可以再分,而原子不能再分
A.①②③⑤ B.①②④⑤ C.①③⑤ D.①②③④⑤
12.某课外活动小组的同学,为制备有关物质所设计的下列途径中,正确的是
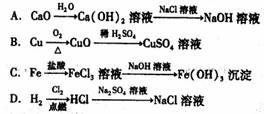
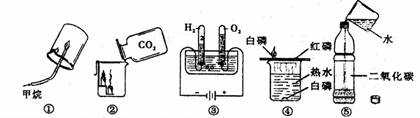
13.通过下列实验得出的结论,其中正确的是

①既说明了甲烷具有可燃性,又可说明甲烷是由氢元素和碳元素组成
②既说明了二氧化碳的密度比空气大,又可说明二氧化碘不能燃烧也不支持燃烧
③既说明了水是由氢元素、氧元素组成,又可说明水分子中氢氧原子个数之比为2:1
④既可探究可燃物的燃烧条件,又可说明白磷的着火点比红磷低
⑤既说明了二氧化碳易溶于水,又可说明二氧化碳具有酸性
A.①②③④ B.②③④⑤ C.②③④ D.①②③④⑤
14.如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是
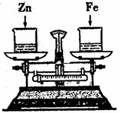
A. 向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左偏
二、填空题(16分)
31.(2分)下列物质中:①酒精 ②矿泉水 ③明矾
④干冰 ⑤硫酸铜
(1)可用于人工降雨的是(填序号,下同) ,(2)可用于净水的是 。
32.(2分)运用你所学到的化学知识解释:
(1)墙内开花,墙外可嗅到花香,是因为 ;
(2)硫酸、盐酸等酸类物质具有一些相似的化学性质、是因为 。
33.(4分)元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:
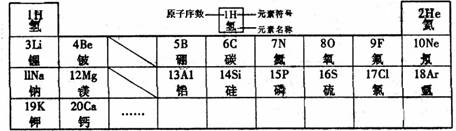
根据表中信息,回答:
(1) 地壳中含量最多的金属元素的符号是 ;
(2)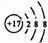 表示的是(填名称) ; 表示的是(填名称) ;
(3) 由1、8、12号元素组成化合物的化学式 ;
(4) 上表中每一周期元素原子序数的变化规律是 。
34.(3分)如图所示, A、B、C、D、E、F均是初中化学常见物质。A与B发生的是复分解反应,B与C发生的是中和反应,F是人们日常生活中最重要的调味品。
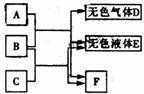 回答下列问题: 回答下列问题:
(1)E的化学式为 ;
(2)A与B反应的化学方程式为 ;
(3)C与D反应的化学方程式为 。
35.(5分)右图所示是高炉炼铁时高炉内的化学变化过程。认真阅读有关信息,回答: 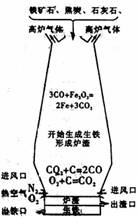
(1)将铁从铁矿石中还原出来的物质是(填化学式) ;
(2)取少量高炉中炼出的生铁放人烧杯中,加入稀盐酸、可观察到的现象是 ,反应的化学方程式为 ,
当反应停止后,还可观察到烧杯底部有黑色固体不溶物,该物质是(填化学式) ,请设计一个简单实验证明你的判断,简要写出主要操作和现象
三、实验与探究(11分)
36.(5分)实验是学习化学的一个重要途径。请从下列仪器中选用适当仪器用H2O2与MnO2制取并收集O2。
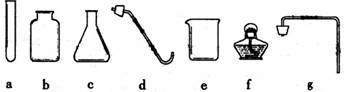
(1)仪器e的名称是 ;
(2)若用排空气法收集O2,产生并收集气体应该选用的仪器有(填代号) ,装入药品前必须进行的一步操作是 ;
(3)反应的化学方程式为 ;
(4)检验O2是否已经集满的方法是 。
37.(6分)右图是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
△△牌发酵粉
[主要成分]
NaHCO3、酒石酸
[用 途]
面粉发酵、焙制糕点
[用 法]
取本品适量加水溶解与面团揉和均匀或直接与面团揉和均匀后加热 |
查阅资料]
(1)酒石酸是一种易溶解于水的固体有机酸;
(2)发酵粉能够使面团松软、发泡是由发酵粉产生的CO2所致;
(3) Na2CO3受热不分解。
[提出问题]
NaHCO3在发酵粉加水或加热时如何产生CO2?
[猜想]
甲. ……
乙. 酒石酸与NaHCO3在溶液中反应产生CO2
丙.NaHCO3加热产生CO2
[实验探究]
(1)小明同学取少量NaHCO3粉末于试管中,咖入适量水,无气体产生,从而否定了猜想甲,则猜想甲是 。小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,
从而验证了猜想乙,说明了NaHCO3具有的性质之一是 ;
(2)小英同学为探究猜想丙,设计了右图所示的实验装置:

小英另取适量NaHCO3粉末加入a试管中,加热,观察到a试管口有水生成,b试管中澄清右灰水变浑浊。b试管中反应的化学方程式为 。 持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是 。
[小 结]
NaHCO3在发酵粉中产生CO2的条件是 ;
NaHCO3受热发生变化的化学方程式为 。
四、计算题(8分)
38.(8分)硝酸铵是农业生产中常用的化学肥料。为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取2.0g该硝酸铵样品于容器中,滴人5.0g20%的NaOH溶液。发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O。反应过程中放出的氨气质量及加人的NaOH溶液的质量的关系如右图所示:
完成有关计算:
(1) NH4NO3中各元素的质量比为(H:N:O) ;
(2)样品中硝酸铵的质量分数;
(3)所得溶液中NaNO3的质量分数。
化学试题参考答案及评分意见
一、选择题(35分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
答案 |
A |
D |
C |
B |
D |
B |
C |
D |
C |
A |
A |
B |
C |
D |
二、填空题(本大题共4小题,每空1分,共16分}
31. (2分) (1) ④; (2)③。
32. (2分) (1) 分子在不停地运动; (2) 它们在水溶液中都能离解出H+。
33.(4分) (1) A1; (2) 氯离子;
(3) Mg(OH)2; (4) 从左到右原子序数依次增大。
34. (3分) (1) H2O;
(2) Na2CO3+2HCl =2NaCl+H2O+CO2↑;
(3) CO2+2NaOH= Na2CO3+H2O。
35,(5分) (1) CO;
(2) 有气泡产生、溶液逐渐变为浅绿色; Fe+2HCl=FeCl2+H2↑;
C;将黑色固体放在坩埚内加热至其燃烧,并在火焰上方罩一个杯壁沾有澄清石灰水的烧杯,杯壁出现白色斑点。(答对要点均给分)
三、实验题(每空1分,共11分)
36. (5分) (1) 烧杯; (2) a、b、g,检验装置的气密性;
(3) 2H2O2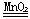 2H2O+O2↑; (4) 用带火星的木条靠近瓶口,如果木条 2H2O+O2↑; (4) 用带火星的木条靠近瓶口,如果木条
复燃,则集满。
37. (6分)NaHCO3遇水产生CO2;与某些酸反应产生CO2;
Ca(OH)2+CO2=CaCO3↓+H2O; Na2CO3;
加水或加热,2 NaHCO3  Na2CO3+CO2↑+ H2O Na2CO3+CO2↑+ H2O
四、计算题(8分)
38.(8分) (1)1:7:12 (2分)
解:(2) 设2.0g样品中含NH4NO3的质量为x,反应生成NaNO3的质壁为y,反应生成的NH3的质量为z,则
NH4NO3+ NaOH= NaNO3+NH3↑+ H2O
80 40 85 17
X 4g×20% y z
x=1.6g (1分)
y=1.7g (1分)
z=0.34g (1分)
样品中NH4NO3的质量分数为:(1.6g/2.0g)×100%=80% (1分)
(3)反应后所得溶液中NaNO3的质量分数:
[(2.0g-1.6g+1.7g)/(2.0g+5.0g—0.34g)] ×100%=31.5% (2分)
答:(略)
(注:其他解法只要合理,过程清楚、结果正确均应给分)
|