|
全国初中化学素质和实验能力竞赛
(第十二届天原杯)复赛试题
一、选择题(有1个或2个选项符合题意,共24分)
1、“垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅、铝质易拉罐、铜导线等可以归为一类加以回收,它们属于
A、有机物 B、金属或合金 C、氧化物 D、盐
2、来自海洋深处的可燃冰的主要成分是
A、CH4 B、H2 C、CO D、CO2
3、一辆客车夜晚行驶在公路上,发现油箱漏油,车箱里充满了汽油的气味,这时应该采取的应急措施是
A、洒水降温并溶解汽油蒸气
B、开灯查找漏油部位,及时修理
C、打开所有车窗,严禁一切烟火,疏散乘客离开车箱
D、让车内人员坐好,不要随意走动
4、现代医学证明,人类牙齿由一层称为碱式磷酸钙的坚硬物质保护着。碱式磷酸钙的化学式中除钙离子外,还含有一个氢氧根离子和三个磷酸根离子,则其化学式正确的是
A、Ca2(PO4)3(OH)
B、Ca3(PO4)3(OH)
C、Ca4(PO4)3(OH)
D、Ca5(PO4)3(OH)
5、1999年度诺贝尔化学奖授予了开创“飞秒(10-15s)化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子运动成为可能。你认为该技术不能观测到的是
A、原子中原子核的内部结构
B、化学反应中原子的运动
C、化学反应中生成物分子的形成
D、化学反应中反应物分子的分解
6、常温下,取下列固体各10g,分别与90 g水充分混合,所得溶液中溶质质量分数最小的是
A、Na2O B、CaO C、SO3 D、CuSO4·5H2O
7、向一定量的饱和NaOH溶液加入少量Na2O固体,恢复到原来温度时,下列说法正确的是
A、溶液中Na+总数不变
B、单位体积内OH-的数目不变
C、溶质的质量分数不变
D、溶液的质量不变
8、配制一定溶质质量分数的氢氧化钠溶液时,造成所配制溶液的溶质质量分数偏高的原因可能是
A、所用的NaOH已潮解
B、用带游码的托盘天平称量NaOH固体质量时,误将砝码放在左盘,被称量物放在右盘
C、托盘天平的左右托盘上各放一张纸,调整天平至平衡后,将NaOH固体放在纸上称量
D、用量筒量取水时,俯视水面刻度线来读取体积读数
9、天然气、液化石油气燃烧的化学方程式分别为:CH4 + 2O2 = CO2 + 2H2O; C3H8 + 5O2 = 3CO2+4H2O。现有一套以天然气为燃料的灶具,要改为以液化石油气为燃料的灶具,应采取的措施是
A、燃料气和空气的进入量都减少
B、燃料气和空气的进入量都增大
C、减少燃料气进入量或增大空气进入量
D、增大燃料气进入量或减少空气的进入量
10、将Mg,Al,Zn分别放入相同溶质质量分数的盐酸中,反应完成后,放出的氢气质量相同,其可能原因是
A、放入的三种金属质量相同,盐酸足量
B、放入的Mg,Al,Zn的质量比为12:9:32.5,盐酸足量
C、盐酸的质量相同,放入足量的三种金属
D、放入的盐酸质量比为3:2:1,反应后盐酸无剩余
11 、由NaHS、MgSO4、NaHSO3组成的混合物中,已知S元素的质量分数w(S)=a%,则O元素的质量分数w(O)为
A、1.75 a% B、1-1.75 a% C、1.25 a% D、无法计算
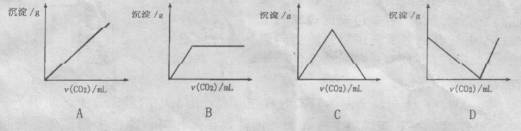
12、将二氧化碳通入澄清石灰水中,有白色沉淀生成,若继续通入二氧化碳,白色沉淀将完全溶解。其反应的化学方程式为:Ca(OH)2 +CO2 = CaCO3↓+ H2O; CaCO3 +CO2 +H2O = Ca(HCO3)2当二氧化碳持续不断地通入澄清的石灰水中时,沉淀质量的变化符合下列图像中的
二、填空题(本题包括10小题共40分)
13、近年来出现的厄尔尼诺现象与大气中二氧化碳含量的增多有关,请回答以下问题:
(1)空气中二氧化碳主要来源是 ;
(2)自然界中能消耗二氧化碳的是 作用,写出该反应的文字表达式
(3)为减缓此现象,你认为最理想的燃料是 ,以水为原料,开发此燃料,你认为应研究的主要课题是 。
14、地球的外层空间存在微量的臭氧和氧原子,该臭氧层的存在能吸收和阻挡太阳有害的紫外线的强烈辐射。可是人为的大气污染物会破坏臭氧层,如超音速飞机排放的氮氧化物(NO和NO2),它们和O3及O发生如下反应:O3 + NO = NO2 + O2;O +NO2 = NO + O2 ;这两个反应反复循环,其总反应方程式为: 。氮的氧化物在破坏臭氧层的过程中起了 作用。
15、已知Fe元素在化合物里通常显+2或+3价,因此Fe3O4可写成氧化物形式FeO·Fe2O3,或盐的形式Fe(FeO2)2,它属于偏铁酸盐。Pb在化合物里显+2或+4价,那么Pb3O4也可以写成 或 。
16、CO与PdCl2溶液反应产生黑色金属钯粉末,反应中有水参加,利用此反应可用氯化钯(PdCl2)检测CO对大气的污染情况,此反应的化学方程式为 。反应CO具有 性。
17、磷酸二氢铵是一种含有氮、磷两种营养元素的复合肥,熟石灰常可用来中和土壤的酸性,但是这两种物质不宜混合使用,试写出有关反应的化学方程式 ,并说明原因 。
18、将雕刻成球型的冰糖(其化学成分为蔗糖)置于蔗糖的饱和溶液中,保持温度和溶剂质量都不变,几天后,小球的质量和形状有无变化?
19、已知在相同温度下,气体分子的运动速度与分子的相对分子质量有关,分子的相对分子质量越大,则其运动速度越小。图中容器A是一种特制的有底的素烧瓷筒,它的壁可通过氢气分子。实验开始时,A中的烧杯都充满空气。当向烧杯中持续通入氢气时,导管B处发生的现象是 ,产生这种现象的原因是 。
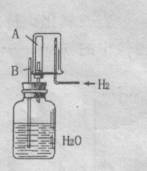
20、2001年11月,美军为打击躲藏在阿富汗山洞中的恐怖分子,使用了一种为BLU—82的高效能燃料炸弹。这种炸弹爆炸时,除能产生高温外,还可使山洞内的氧气耗尽,使其中的所有生物窒息死亡而山洞不致完全崩塌,以便后续军队进入山洞鉴别死者身份。燃料空气弹的主装药之一是环氧乙烷 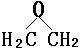
它的化学式可写作 。爆炸时,环氧乙烷先成雾状分散在空气中,然后爆炸,反应的生成物为 , , 。
21、下表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明:
|
配料 |
氯化钠、碘酸钾 |
|
含碘盐 |
(20mg~40mg)/kg |
|
保质期 |
18个月 |
|
食用方法 |
勿长时间炖炒 |
|
贮藏指南 |
避热、避光、密封、防潮 |
(1) 已知碘在碘酸钾中的化合价为+5,碘酸钾的化学式为
(2) 由食用方法和贮藏指南可推测碘酸钾的化学性质之一是
(3) 用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为 。
22、下表是我国部分城市空气质量周报,阅读并回答下列问题:
|
城市 |
污染指数 |
首要污染物 |
空气质量级别 |
城市 |
污染指数 |
首要污染物 |
空气质量级别 |
|
北京 |
92 |
TSP |
Ⅱ |
济南 |
76 |
TSP |
Ⅱ |
|
天津 |
82 |
TSP |
Ⅱ |
武汉 |
83 |
NOx |
Ⅱ |
|
哈尔滨 |
96 |
TSP |
Ⅱ |
重庆 |
98 |
SOx |
Ⅱ |
|
上海 |
74 |
NOx |
Ⅱ |
贵阳 |
69 |
TSP |
Ⅱ |
|
注:TSP—空气中的飘尘;NOx—氮的氧化物;SOx—硫的氧化物。 |
(1)最容易出现酸雨的城市是 。为减少城市酸雨的产生,可采取的措施是
① 少用煤作燃料; ②采用燃料脱硫技术; ③向已酸化土壤中加石灰; ④开发新能源
(2)汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO与NO反应,可生成参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式 。控制城市汽车尾气对空气造成污染的方法是
① 开发氢能源;②使用电动车;③植树造林;④戴呼吸面具。
三、实验题(本题包括4小题,共24分)
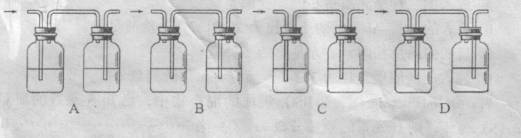
23、某学生在A、B、C、D四只烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,
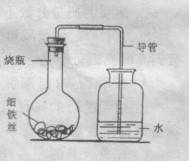
每隔一段时间测量导管中水面上升的高度,结果如下表所示。
(表中所列数据为导管中水面上升的高度/cm)
|
时间/小时 |
0 |
0.5 |
1.0 |
1.4 |
2.0 |
2.5 |
3.0 |
|
A瓶(盛干燥铁丝) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
B瓶(盛沾了食盐水的铁丝) |
0 |
0.4 |
1.2 |
3.4 |
5.6 |
7.6 |
9.8 |
|
C瓶(盛沾了清水的铁丝) |
0 |
0 |
0 |
0.3 |
0.8 |
2.0 |
3.5 |
|
D瓶(盛完全浸没在食盐水中的铁丝) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
(1) 导管中水面为什么会上升?
(2) 上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧杯号);
(3) 影响铁生锈的因素有:
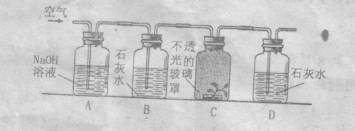
24、实验室制得的氢气中常含的水蒸气和少量酸雾,为了获得纯净的氢气可选用下图中的第 套装置来净化。
(1)其中左瓶中应盛 以除去 ;右瓶中应盛 以除去 。
(2)实验完成后,如果回收的废液中含有少量硫酸及硫酸亚铁,怎样利用废液再回收较纯的硫酸锌晶体?
25、下图是测定植物某一生命活动过程的装置。A瓶中的氢氧化钠溶液的作用是 ,B瓶中的石灰水的作用是 ,D瓶中出现的现象是 。此实验说明植物具有 。
26、某化学实验小组为测定生石膏的组成(CaSO4·xH2O),即测x的值,做了如下实验,将含结晶水的硫酸钙放在坩埚中加热,加热前和加热后都进行称量,随着实验次数的增加,加热的时间不断延长。它们的实验数据整理如下:
|
实验顺序
(按序延长加热时间) |
固体质量/g |
|
加热前 |
后 |
|
1 |
3.44 |
3.26 |
|
2 |
3.44 |
3.12 |
|
3 |
3.44 |
2.90 |
|
4 |
3.44 |
2.90 |
|
5 |
3.44 |
2.80 |
|
6 |
3.44 |
2.78 |
|
7 |
3.44 |
2.72 |
|
8 |
3.44 |
2.72 |
利用数据可绘制成以下图像:
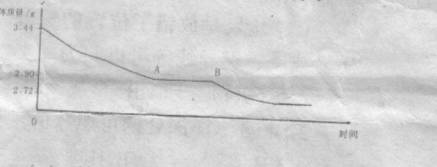
(1) 利用实验数据,通过计算推断生石膏的化学式。
(2) 通过计算解释图像中产生AB段的原因。
四、计算题(本题包括2小题,共12分)
27、有一置于水中用特殊材料制成的密闭容器,气体分子可以通过该容器的器壁,而液体和固体不能通过。容器质量为1g,体积为0.04L。容器内盛有32.5g质量分数为40%的稀硫酸,如果向其中加入锌粒,要想保持容器在水中不沉底,则锌粒的质量最大不能超过多少?
28、减弱“温室效应”的有效措施之一是大量植树造林,绿色植物在叶绿素存在下的光合作用是完成二氧化碳循环的重要一环。已知叶绿素的相对分子质量小于900,其分子含C73.8%(以下均指质量分数),H8.3%,N6.3%,Mg2.7%,其余为O,试确定叶绿素的化学式。
|
2002年全国初中学生化学素质和实验能力竞赛(第十二届天原杯)复赛试题参考答案及评分标准 |
|
一、选择题(本题15小题,每小题2分,共30分。每小题有1个或2个选项符合题意。若有两个答案的错1个不得分,漏选1个扣1分。)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
B |
A |
C |
D |
A |
B |
B、C |
D |
C |
B、C |
B |
C |
二、填空题(本题包括10小题,共40分)
13.(1)煤等燃料的燃烧、动植物的呼吸等(2分)
(2)光合作用 (1分)
水+二氧化碳 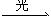 淀粉+氧气 (1分) 淀粉+氧气 (1分)
(3)氢气,开发适宜的催化剂或如何使用廉价能源使水分解。(只要研究的内容科学,且能实现就可给分)(2分)
14.O3+O=2O2 ;催化剂 (各2分,共4分)
15.2PbO·PbO2;Pb2(PbO4) (各1分,共2分)
16.CO+PdCl2+H2O=2HCl+Pd+CO2 (2分)
还原 (1分)
17. 2NH4H2PO4+3Ca(OH)2=Ca3(PO4)2↓+2NH3↑+6H2O (2分)
生成的Ca3(PO4)2难溶于水,不易被植物吸收,同时氮元素由于以氨气形式逸出而损失(2分)
18.(1)冰糖形状改变,其质量不变(2分)
19.有水喷出 (2分)
氢气分子的相对分子质量比较小,运动速度快,一定时间内进入A的氢气分子数目比从A中逸出的空气分子数目多,使A和瓶中的压强大于大气压强,故有水从B中喷出 (3分)
20.C2H4O (1分)
CO2、CO、H2O (3分)
21.(1)KIO3 (1分)
(2)不稳定,受热易分解(1分)
(3)I2+2KClO3==2KIO3+Cl2 (2分)
22.重庆,①②④ (3分)
(2)2CO+2NO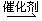 2CO2+N2,①② (3分) 2CO2+N2,①② (3分)
三、实验题(包括4小题,共24分)
23.(1)铁生锈时跟空气中的氧气反应,消耗了氧气而使小烧杯中气体压强降低(2分)
(2)B>C>A=D (1分)
(3)①跟氧气接触;②有水分存在;③有电解质(或答盐)存在,三者同时具备时铁生锈速度最快。(3分)
24.C、氢氧化钠溶液、酸;浓硫酸、水蒸气(各1分,共5分)
向废液中加入足量锌粉,充分反应后过滤,将滤液蒸发、冷却、结晶即可得较纯的硫酸锌晶体。(2分)
25. 吸收空气中的CO2,证明空气中的CO2已经完全除去,溶液变浑浊,呼吸作用 (各1分,共4分)
26.(1)CaSO4·xH2O = CaSO4 +xH2O
136+18·x 136 18·x
3.44 g 2.72 g 0.72 g (2分)
x = (136×0.72 g) / (2.72 g×18) = 2
生石膏化学式为CaSO4·2H2O (1分)
(2)实验数据和图象AB段说明在生石膏受热分解过程中,有一固定组成的化合物存在,按实验数据计算: (1分)
CaSO4·2H2O = CaSO4·yH2O + (2-y)H2O (1分)
172 136+18·y
3.44 g 2.90 g
18y =[ (172×2.90 g) /3.44 g]-136 = 9 y = 1/2
该化合物为2CaSO4·H2O(或CaSO4·1/2H2O) (1分)
因为在加热过程中生石膏CaSO4·2H2O转化为相对稳定的2CaSO4·H2O,因此图像中有AB段。 (1分)
四、计算题(包括2小题,共12分)
27.解:
要使容器在水中不下沉,容器和它内部的物质产生的重力最大不能超过水对容器的浮力F,即:[m(容器)+m(硫酸)+m(锌粒)-m(氢气)] g = F (2分)
设加入的锌粒的质量为x,由:
Zn + H2SO4 ==ZnSO4 + H2↑
65 2
x 2x/65 生成氢气的质量为x/32.5阶段 (2分)
则有:
[32.5×10-3 kg + 1×10-3 kg + x-(x/32.5)]×9.8 N/kg
= 0.04×10-3 m3×1000 kg/m3×9.8 N/kg
x = 6.5×10-3 kg = 6.5 g (2分)
加入锌粒的质量最大不能超过6.5 g。
28.氧的质量分数为:1-(73.8%+8.3%+6.3%+2.7%)= 8.9%,镁的质量分数最小 (1分)
假设叶绿素中有一个镁原子
则叶绿素的相对分子质量为:24/2.7% = 889 < 900 (2分)
由此说明叶绿素分子中仅含有一个镁原子,其相对分子质量为889。
叶绿素分子中含有碳原子的个数:894×73.8% /12 = 55;
类推:H 74,O 5,N 4 (2分)
所以叶绿素的化学式为:C55H74O5N4Mg (1分) |
|