|
全国初中化学素质和实验能力竞赛
(第十一届天原杯)复赛试题
一、填空题(共15分)
1.八硝基立方烷是一种新型烈性炸药,它的化学式为C8(NO2)8,一经引爆,这种炸药便能分解为极稳定的气体:CO2和N2。八硝基立方烷分子中,各种元素原子的最简整数比 ,写出八硝基立方烷爆炸反应的化学方程式 。
2.根据下列结构示意图,用序号回答:
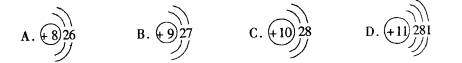
①上述微粒有两种能形成X2Y型离子化合物,X是 ,Y是 。
②具有稳定的最外电子层结构的微粒是 。
3.用煤火取暖或使用燃气热水器冲凉,都可能发生煤气中毒的悲剧,请回答:
①煤气的有毒成份的化学式是 。
⑦煤燃烧时产生煤气的条件是 。
⑦煤气使人中毒的生理过程是
。
4.硫原子与氧原子的最外电子层上都有—个电子,它们的化学性质很相似,在某些化合物中,硫原子可以代替氧原子。写出下列化学方程式:CO2通入CaO的水溶液中 。CS2与Na2S的水溶液混合振荡 。
5.右图是A、B两种物质在水中的溶解度曲线。
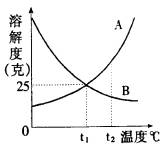
①当B物质的水溶液接近饱和时,可采用 三种方法使其达到饱和。
②t1℃时,200克A的饱和溶液的溶质质量分数是 。
二、选择题(共20分,每小题有一个正确答案)
6.下列物质中,属于纯净物的是:
A.石油 B.干燥的空气 C.五水硫酸铜 D.澄清石灰水
7.某化合物,其组成中没有C、H、O三种元素。这种化合物可能属于:
A.酸 B.碱 C.盐 D.有机物
8.物质发生化学变化的主要特征是:
A.有新物质产生 B.发光或放热 C.颜色改变 D.有气体或沉淀生成
9.质子数和电子总数都与NH4+相同的微粒是:
A.NH3 B.Na+ C.K+ D.H2O
10.要比较准确地量取2毫升盐酸,应使用的仪器是:
A.试管 B.标明容积多少的烧杯 C.胶头滴管 D.10毫升的量筒
11.对于反应CO十CuO Cu十CO2,有关此反应的叙述,正确的是: Cu十CO2,有关此反应的叙述,正确的是:
A.是置换反应 B.是复分解反应 C.氧化剂是CuO D.氧化剂是CO2
12.与n个硫酸分子中所含的氧原子个数相等的是:
A.n个CO2分子 B.4n个水分子 C.4n个氧气分子 D.2n个硝酸分子
13.下列哪种方法不会使试管炸裂:
A.加热固体物质时,试管口向上倾斜 B.加热时试管的底部触及酒精灯灯芯
C.不使用石棉网而直接给试管加热 D.未经均匀受热就立即固定加热试管
14.下列哪种物质在氧气中燃烧时,发出耀眼白光,放出大量热并生成白色粉末:
A.木炭 B.铁丝 C.红磷 D.镁条
15.把t℃时50克20%的KNO3溶液在恒温下蒸发掉10克水,有1克KNO3固体析出,则KNO3在t℃时的溶解度为:
A.10克 B.22.5 C.25克 D.30克
三、选择题(以下各题有1或2个正确答案,多选错选都不给分,如果有两个正确答案,仅选一个且选对的,给1分。每小题3分,共15分)
16.下列叙述,正确的是:
A.可以生成盐和水的反应称为中和反应 B.碱的分子中必定含有氢元素和氧元素
C.生成单质的反应,有可能是置换反应 D.通过化合反应,无法得到单质
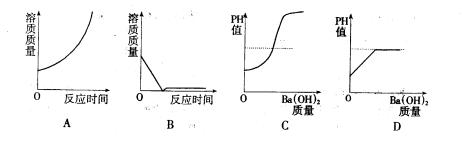
17.向盛有4.9克20%的硫酸中,慢慢滴加10克20%的Ba(OH)2溶液,能正确表示其变化的图象是:
18.由于大气中CO2含量增加,产生“温室效应”,使地球变热,海平面升高,陆地面积减少。为了减少大气中CO2的含量,下列措施可行的有:
A.改变能源结构,发展太阳能、核能、水能,以代替矿物燃料
B.用石灰水吸收空气中的CO2
C.限制汽车工业的发展,减少汽车数量
D.开展植树造林,增大绿化面积。
19.在一个密闭的钢筒内有四种物质,通过电火花引燃后,发生充分反应,测得反应前后各物质的质量如下:
|
|
甲 |
乙 |
丙 |
丁 |
|
反应前质量(克) |
4 |
10 |
1 |
25 |
|
反应后质量(克) |
未测 |
21 |
10 |
9 |
已知甲的式量为n,丁的式量为2n,则该反应的化学方程式中甲与丁的系数比为:
A. 1∶ B. 1∶ C. 1∶ D.2∶
20.(CHCl3)不溶于水,密度比水大,是一种良好的有机溶剂,若保存不当受到光照射时,易被氧化而产生剧毒光气(COCl2),反应如下:
2CCl3 + O2 2HCl +2COCl2 下列有关氯仿的实验操作正确的是 2HCl +2COCl2 下列有关氯仿的实验操作正确的是
A.用酚酞试液检验氯仿是否变质 B.用硝酸银溶液检查氯仿是否变质
C.用蒸馏水检查氯仿是否变质 D.在教室里倾倒氯仿做检查实验
四、简答题:(共19分)
21.(1)酸雨水样随时间增长,其酸性增强,其原因是酸雨中的亚硫酸(H2SO3)被空气中的氧气氧化成硫酸,写出这个氧化过程的化学方程式
。
(2)以石灰石、水、碳酸钠为原料,制取氢氧化钠,写出有关的方程式:
属 反应类型
属 反应类型
属 反应类型
22.有一种固体混合物,可能由CuSO4、CaCO3、Na2CO3、BaCl2、NaCl中的一种或几种组成,现取该混合物进行如下实验:①将固体温合物溶于水中,搅拌后完全溶解得到无色溶液。②往此溶液滴加盐酸,产生一种能使澄清石灰水变浑浊的无色无味气体。据此,试推断:
该固体混合物中一定有 ,不能肯定是否存在的是 。
23.右图有A——F 6种物质,它们是Fe、H2SO4、Ca(OH)2、Cu(NO3)2、Na2CO3和BaCl2。图中凡是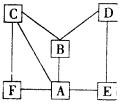 用直线相连的两种物质均可发生化学反应。试推断:B 、C 、F 。 用直线相连的两种物质均可发生化学反应。试推断:B 、C 、F 。
24.为什么稀释浓硫酸时,把水倒入浓硫酸中会造成严重事故?
答:_______________
五、实验题(23分)
25.现有A贮气瓶中的混合气体(主要有CO,内含少量CO2),以A为原料制备纯净干燥的CO去还原氧化铜,并验证反应产物。依照图示装置回答:
(1)请用字母标号表示装置连接的正确顺序:
A→ → → → →
(2)C装置中观察到的现象是 。
(3)B装置的作用是 ,其反应方程式是
。
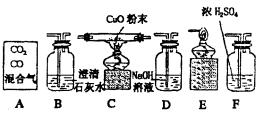
(4)D装置的作用是 。
(5)上述整套装置中发生的化学反应,其中属于化合反应的化学方程式为
。
26.若从H2SO4、Na2SO4、Na2CO3、NaCl、NaNO3、Cu(NO3)2 、HNO3等7种溶液中取出其中的2种,进行混合及有关实验,所观察到的现象已记录在下表中。试据各步实验及其现象先进行分步推断(即实验进行到该步所能作出的某物质肯定存在、否定存在或可能存在的判断),再综合推断所取出的2种溶液的可能组合。
|
步骤 |
实验操作 |
实验现象 |
分步推断 |
|
⑴ |
将取出的2种溶液 进行混合 |
混合溶液无色、澄清 |
混合溶液中肯定不含Cu(NO3)2 |
|
无其他明显现象 |
混合溶液肯定不是下列组合: |
|
⑵ |
用pH试纸测定混合 溶液的PH |
测定结果:pH=2 |
|
|
⑶ |
向混合溶液中滴入 足量Ba(NO3)2溶液 |
有白色沉淀出现 |
|
|
⑷ |
向上述溶液过滤所得的滤液中滴加AgNO3 |
无明显现象 |
|
|
混合溶液的可能组合(写出溶质的化学式,有几组要写几组) |
① 和 ; ② 和
③ 和 ; ④ 和
O 和 ; O 和 |
六、计算题(8分)
27.(8分)某种天然碱样品的化学式可以用xNaHCO3·yNa2CO3·zH2O表示(式中x、y、z是最简整数比)。取50克某一浓度的盐酸与3.32克样品充分反应,能生成1.32克CO2气体。
(1)若改用1.66克样品与50克这种盐酸反应,能产生 克CO2。
(2)另取3.32克样品在300℃下加热至完全分解(已知Na2CO3在300℃时不会分解),能产生0.22克CO2和0.45克H2O,试确定该样品的化学式:
。
(3)写出这种天然碱与盐酸完全反应的化学方程式。若6.64克天然碱样品与50克该盐酸充分反应时放出的CO2最多,求该盐酸的溶质质量分数。
参 考 答 案
一、(共15分,每空1分)
1.C∶0∶N=1∶2∶1 C8(NO2)8=8C02十4N2 2.①D A.②C
3.①C0 ②空气不足 ③C0与血液中的血红蛋白牢固结合,使血红蛋白不能很好地与02结合,人体就缺少氧气
4.6 CO2十CaO十H2O====CaCO3十H2O CS2十Na2S====Na2CS3
5.①加溶质、减溶剂、升温 ②25/125=20%
二、(共20分)
6.C 7. C 8.A 9. B 10. D 11;C 12. B 13.C 14. D
三、(共15分)
16.BC 17.BC 18.AD 19.B 9.B
四、(共19分)
21.(1)2H2SO3+O2=====2H2SO4
(2)CaCO3====CaO十CO2↑ 分解
CaO十H2O===Ca(OH)2 化合
Ca(OH)2十Na2CO3=CaCO3十2NaOH 复分解
反应式、反应类型各1分,共7分
22.一定有NaCO3 未能确定的是NaCl (每个化学式各2分,共4分)
23.B.Ca(OH)2 C.Na2CO3 F.BaCl(6分)
24.水的密度较小,水流进浓硫酸会浮在硫酸上面,溶解时放出的热立刻使水沸腾,硫酸液滴飞溅。(2分)
五、(共23分)
25.(11分)①D F C B E(3分) ②黑色粉末逐渐变红色(1分)
③验证反应产物(1分) CO2十Ca(OH)2=CaCO3↓十H2O(2分)
④吸收混合气体中的CO2 (2分)
⑤2CO+O2=====2CO2 (2分)
26.(12分)
(1)H2SO4和Na2CO3,HNO3和Na2CO3
(2)混合溶液中至少有1种是H2SO4或HNO3,肯定不含Na2CO3
(3)混合溶液中至少有1种是H2SO4或Na2SO4
(4)混合溶液中肯定不合NaCI (各2分,共8分)
评分提示:设置“分步推断”给分点的意图在于考查思维过程及其表述,评分可从宽掌握,但只能对遗漏从宽,对错误还应从严。表述方
式不限,正确、清楚即可。
①H2SO4和Na2SO4 ②H2SO4和NaNO3
③H2SO4和HNO3 ④HNO3和Na2SO4
(各1分,共4分)
评分提示:各答案的先后位置不限,但多答或错答一组要倒扣1分。
六、计算题(8分)
27.(共8分)
(1)0.66 2分
(2)2NaHCO3======CO2十H2O十Na2CO3
84×2 44 18
x1 0.22 x2
xl=WNaHCO3==0.84克 1分
x2=0.09
样品中的结晶水=0.45—0.09=0.36克 1分
样品中的Na2CO3=3.32—0.84—0.36=2.12克 1分
x∶y∶z==0.84/84∶2.12/106∶0.36/18==1∶2∶2
即为NaHCO3·2Na2CO3·2H2O 1分
(3)设该盐酸的溶质质量分数为C。
NaHCO3·2Na2CO3·2H2O十5HCl=5NaCl十3CO2十5H2O
332 5×36.5
6.64 50×C
C=6.64× 5×36.5/332×50=7.3% 1分
答:略
|