| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
试推断a、b、c、d依次是( ) A、H2SO4 Na2CO3 BaCl2 HCl B、HCl H2SO4 Na2CO3 BaCl2 C、Na2CO3 H2SO4 HCl BaCl2 D、BaCl2 HCl Na2CO3 H2SO4 二、填空题: 1.实验室有失去标签的三瓶溶液,分别是NaCl、BaCl2和Na2CO3溶液中的某一种,试用两种方法把它们区别开来,请简要写出实验步骤、现象和结论。 2.某化工厂甲、乙两车间排放的废水中分别含有Na2SO4、CuSO4、BaCl2、FeCl3和NaOH中的三种或两种,两车间各自的污水中均无沉淀物,但对环境均有污染。若将两车间排放的污水按适当的比例充分混合,经沉淀过滤,滤液中只含有一种钠盐,从而减少了污染。试推断乙车间的废水中含有的两种物质是______________________________(写化学式,下同),滤液中的钠盐是__________________________________________________________,滤渣中的物质有_________________________________________。 3.有一种固体混合物,可能由CuSO4、CaCO3、Na2CO3、BaCl2、NaCl中的一种或几种组成,现取该混合物进行如下实验:①将固体混合物溶于水中,搅拌后完全溶解得到无色溶液;②往此溶液中滴加盐酸,产生一种能使澄清石灰水变浑浊的无色无味气体。据此试推断:该固体混合物中一定有_________________,不能肯定是否存在的是_________________。 4.若从H2SO4、Na2SO4、Na2CO3、NaCl、NaNO3、Cu(NO3)2、HNO3七种溶液中取出其中的2种进行混合及有关实验,所观察到的现象已记录在下表中,试根据各步实验及其现象先进行一下分步推断(即实验进行到该步所能作出的某物质肯定存在,肯定不存在或可能存在的判定),再综合推断所取出的2种溶液的可能组合。
| 步骤
| 实验操作
| 实验现象
| 分步推断
| (1)
| 将取出的2种溶液进行混合
| 混合溶液无色、澄清
| 混合溶液中肯定不含Cu(NO3)2
| 无其它明显现象
| 混合溶液肯定不是下列组合
| (2)
| 用pH试纸测定混合溶液pH
| 测定结果:pH=2
|
| (3)
| 向混合溶液中滴入足量的Ba(NO3)2溶液
| 有白色沉淀出现
|
| (4)
| 向上述溶液过滤所得的滤液中滴加AgNO3溶液
| 无明显现象
|
| 混合溶液的可能组成(写出溶质的化学式,有几组要写几组)
| ①____________和____________; ②____________和____________; ③____________和____________; ④____________和____________; ○____________和____________; ○____________和____________。 | |||||||||||||||||||||
5.A、B、C、D、E五种物质之间存在下列转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
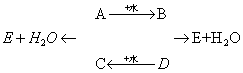
已知A、D是两种可溶于水的氧化物,在A的水溶液中加入BaCl2溶液,有不溶于水也不溶于稀硝酸的白色沉淀生成。E溶液中含有带一个单位正电荷的阳离子,该离子与氖原子具有相同的电子层结构。通过推断,写出下列两种物质的化学式:
A E
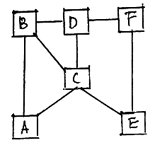 6.如右图A、B、C、D、E、F分别代表
6.如右图A、B、C、D、E、F分别代表
①Na2CO3溶液 ②ZnSO4溶液 ③BaCl2溶液
④稀H2SO4 ⑤Fe ⑥Cu(NO3)2溶液六种物质中
的各一种。图中凡是用直线连接的相邻物质均能
发生化学反应。
则图中C、F表示的物质的化学式是:
C F
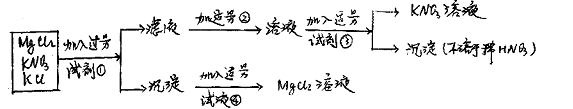 7.根据下列实验流程及结果:
7.根据下列实验流程及结果:
分别写出以上过程中加入的四种试剂的名称或化学式:
① ② ③ ④
8.有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、Na2SO4、KOH中的一种或几种,为了证实其组成,进行如下实验:
(1)取少量的白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则白色沉淀可能是 ,原混合物中一定不含有 。
(2)向实验(1)滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体。原混合物中一定含有 。
(3)将实验(1)中得到的滤液分成两份,将实验(2)中产生的无色气体先通入其中的一份,无沉淀产生。气体导出后再通入另一份滤液中,立即产生白色沉淀,再过滤。出现上述现象的原因是实验(2)中产生的气体里含有 。
(4)向实验(3)中过滤后所得的滤液里加入AgNO3溶液和稀硝酸,又产生白色沉淀,据此现象推断,原混合物中一定还含有 ,根据实验全过程推断,原混合物中还含有 。
9.在一定条件下,反应物溶液中溶质的质量分数越大,化学反应速率越快。现用100g 溶质质量分数为30%的硫酸溶液与过量的镁粉反应,为了减缓化学反应速率,而又不影响生成氢气的总质量,可向硫酸中加入适量的某种物质,现推荐给你的有:NaOH溶液、K2SO4溶液,水、碳酸钠溶液、BaCl2溶液。你认为不可选的是 。
10.某河道两旁有甲、乙两厂,它们排放的工业废水中共含k 、Ag 、Fe2 、Cl-、OH-、NO3-六种离子。甲厂的废水中含有三种离子,且明显呈碱性;乙厂的废水中含有另外三种离子。假如向乙厂的废水中加入一定量的某物质可从直接回收其中的珍贵金属,且没有引入新的污染离子。假如将甲厂和乙厂的废水按比例混合,可以使废水中的某些离子转化为沉淀,经过滤后的废水可用来浇灌农田。试回答:
(1)甲厂的废水中含什么离子?
(2)向乙厂的废水中加什么物质可以回收什么金属?
(3)甲厂和乙厂的废水按比例混合后,哪些离子转化为沉淀,经过滤后的废水中主要含什么物质?
11.x、y、z分别代表zn、cu、Hg中的某一种。实验时,把y投入到xCl2溶液中,其溶液质量增加;把x投入到z(NO3)2溶液中,其溶液质量减少,则x、y、z三种金属分别对应的是 x- 、 y- 、 z- 。
12.A、B、C、D都是初中化学中常见的化合物,它们可以发生F图转化,由此推断A、B、C、D的化学式:A 、B 、C 、D 。
\s 
13.现有甲、乙、丙三种可溶性正盐溶液,按下图所示进行实验,且甲与乙、乙与丙恰好完全反应。
\s 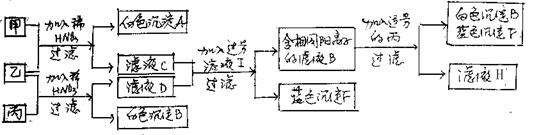 试推断(写出化学式或离子符号)
试推断(写出化学式或离子符号)
溶液甲是 ,沉淀B是 溶液乙是 ,沉淀F是 ,滤液E中的溶质是 ,滤液H中一定含有的阴离子是 。
14.有1、2两组离子
1
Na
Ba2
Mg2
Fe3
2
Cl-
OH-
CO32-
SO42-
它们分别两(阴、阳离子各一种,且离子间可以重复使用)组成化合物A、B、C、D,它们分别具有下列性质:①A既不溶于水,也不溶于酸 ②B是一种碱,向B的水溶液中滴入Na2SO4溶液,则析出A的沉淀 ③C可溶于水形成无色溶液,向C中加入 B的溶液产生白色沉淀,向沉淀中加盐酸时不能完全溶解④D溶于水也得无色溶液,滴入B溶液也有白色沉淀析出,此沉淀遇盐酸完全溶解且生成无色气体。
(1)推出A-D四种物质的化学式:A 、B 、C 、D 。
(2)写出有关的化学方程式:
B和Na2SO4溶液反应 ,
D和B的溶液反应 ,
D和B生成的沉淀溶解的反应 。
专题二 物质的鉴定(检验)、鉴别
1. 为了验证某试液中一定含有SO42-,甲、乙两个同学各设计了一个实验方案。
甲方案:试液 ![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解
沉淀不溶解
乙方案:试液 ![]() 无沉淀
无沉淀 ![]() 白色沉淀
白色沉淀
在上述方案中( )
(A)只有甲正确 (B)只有乙正确
(C)甲、乙都正确 (D)甲、乙都不正确
2.下列各组无色溶液,只用试管和胶头滴管,不用其它任何试剂就可以鉴别的是( )
(A)KOH、Na2SO4、MgCl2 (B)澄清石灰水、Na2CO3、BaCl2
(C)Na2CO3、Ba(OH)2、H2SO4 (D)NaOH、H2SO4、 酚酞试液
3.下列各组溶液,不用加其它试剂就能鉴别的是( )
(A)Na2CO3、H2CO3、HCl、NaNO3
(B)NaOH、NaCl、MgCl2、FeCl3
(C)HCl、AgNO3、HNO3、MgCl2
(D)K2SO4、Na2CO3、BaCl2、HNO3
4.下列括号内的气体是需要检验的杂质,检验方法合理的是( )
(A)H2(CO2、CO) ![]()
(B)H2(CO2、HCl) ![]()
(C)O2(CO) ![]()
(D)CO(H2O、CO2) ![]()
5.现有盐酸、氯化钠、氯化钡、氢氧化钠四种无色溶液,用下列试剂中的一种只做一次实验就可能把它们区别开来。这种试剂是( )
(A)Na2SO4 (B) Na2CO3 (C)AgNO3 (D)(NH4)2CO3
6.可以肯定溶液中大量存在CO32-的理由是( )
(A)加入AgNO3溶液有白色沉淀产生
(B)加入酸有无色无味气体产生
(C)加入CaCl2溶液时有白色沉淀产生,再加稀HCl, 沉淀溶解,产生可使澄清石灰水变浑浊的无色无味的气体
(D)加入Ba(OH)2溶液有白色沉淀产生,再加稀盐酸,反应现象如C所述
7.对未知的无机盐溶液里所含的离子作鉴定,根据下列实验事实做出的判定不一定正确的是( )
(A)加入BaCl2溶液有白色沉淀生成,再加稀盐酸,沉淀不溶解,则原溶液中含有SO42-
(B)向溶液中加稀HNO3酸化,再加AgNO3溶液,有白色沉淀生成,则原溶液中不一定含有Cl-
(C)向溶液中加入盐酸,有无色气体逸出,此气体能使石灰水变浑浊,则原溶液中含CO32-
(D)加入NaOH溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则溶液中含有NH4
8.检验某可燃性化合物是否含C、H、O三种元素,让该物质在氧气或空气中燃烧后,还必须进行的实验是①用带火星的木条检验 ②用无水硫酸铜检验
③用澄清的石灰水硷验 ④对反应物、生成物进行称量( )
(A)①②③④ (B)②③④ (C)①②③ (D)②③
9.氯仿(CH3Cl)不溶于水,密度比水大,是一种良好的有机溶剂,若保存不当受到光的照射时,易被氧化而产生剧毒的光气(COCl2),反应如下: ![]() 。下列关于氯仿的实验操作正确的是( )
。下列关于氯仿的实验操作正确的是( )
(A)用酚酞试液检验氯仿是否变质
(B)用AgNO3溶液来检验氯仿是否变质
(C)用蒸馏水来检验氯仿是否变质
(D)在教室里倾倒氯仿作实验
10.要鉴别蒸馏水、稀盐酸、NaOH溶液,有如下三种物质:①pH试纸 ②石蕊试液 ③酚酞试液,其中能实现区分目的的是( )
(A)只有① (B)只有② (C)只有②和③ (D)①②③都行
二、填空题:
1.欲验证某溶液中含有较大量的Cl-、CO32-、SO42-三种离子,假如只取一次该溶液,用三种试剂分别将三种离子检验出来(要求每加一种试剂能够检验出一种离子),那么加入试剂的先后顺序为(用化学式表示): 、 、 。
2.有以下四种物质①HCl ②CaCl2 ③NaOH ④Ba(OH)2可以从中选出一种,将其分别加入到Na2CO3、 (NH4)2SO4、NH4Cl、NaCl四种溶液中(可微热),会产生四种不同现象,从而将后四种物质区分开,你将挑选的这一种物质是
3.怎样鉴定一瓶无色气体是氯化氢气?
4.如何用最简单的方法区分碳粉和氧化铜两种黑色粉末?
5.现有失去标签的两瓶液体,一瓶是浓硫酸,一瓶是稀硫酸,请你用所学过的物理和化学知识,用两种方法将它们区分开来。
物理方法:
化学方法:
6.为了检验长期暴露在空气中的NaOH溶液是否变质,可选择三种不同物质类别(酸、碱、盐)的试剂进行实验,请你写出所选试剂的化学式:
酸 、碱 、盐 。
7.用最简单的方法区别NaCl和CuSO4两种白色粉末(说明所用试剂、实验现象、结论)
8.区分NaNO3、Mg(NO3)2两种无色溶液时应使用的试剂是 ;
区分Mg(NO3)2、AgNO3两种无色溶液时可使用的物质是 ;
区分酒精和食盐水的最简单,最经济的方法是 ;
专题三 物质的分离与除杂
1.化工厂用饱和食盐水制取Cl2和NaOH,为了除去粗盐中的泥沙及MgSO4、
CaCl2等杂质,可将粗盐溶于水,然后进行如下5项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序正确的是( )
(A)⑤④②①③ (B)④①②⑤③
(C)①⑤④②③ (D)②⑤④①③
2.某电镀厂排出的酸性污水中,含有毒的Cu2 ,欲除去Cu2 并降低污水的酸性,加入下列适量的物质时,不能达到目的的是( )
(A)纯碱 (B)生石灰 (C)食盐 (D)氧化铁
3.要除去下列四种物质中的少量杂质(括号内物质为杂质)
甲:CaCO3(Na2CO3) 乙:NaOH(Na2CO3)
丙:Ku(KHCO3) 丁:炭粉(CuO)
可选用的试剂及操作方法有:
①加适量盐酸、搅拌、过滤 ②加适量水搅拌、过滤
③加适量盐酸、蒸发 ④溶液、加适量石灰水,过滤,蒸发
下列组合正确的是( )
(A)甲—②,乙—④ (B)乙—③,丙—①
(C)丙—①,丁—② (D)丁—①,丙—③
4.某溶液中含有Ba2 、 Ag 、Cu2 ,现有①NaOH溶液;②Na2SO4溶液;③盐酸,现将三种离子逐一沉淀并加以分离,则加入试剂的顺序正确的是( )
(A)①②③ (B)③②① (C)②③① (D)②①③
5.用Na2CO3、BaCl2(Ba2 有毒)、盐酸三种药品除去食盐溶液中含有的CO32-、SO42-,得到纯净的NaCl溶液,则加入药品的合理顺序为( )
(A)盐酸、BaCl2、Na2CO3 (B)BaCl2、盐酸、Na2CO3
(C)Na2CO3、盐酸、BaCl2 (D)BaCl2、Na2CO3、盐酸
6. NaNO3溶液中混有Mg2 、Ba2 、Ag 三种阳离子,现用NaOH、Na2CO3、NaCl三种试剂使它们成为沉淀分离出来,要求每次只加一种试剂,滤出一种沉淀,最后达到除去杂质的目的,则所加试剂顺序正确的是( )
(A)NaCl、Na2CO3、NaOH (B)Na2CO3、NaOH、NaCl
(C)NaCl、NaOH、Na2CO3 (D)NaOH、NaCl、Na2CO3
7. 在Fe(NO3)3溶液中含有少量的AgNO3和Ba(NO3)2杂质,若要除去杂质,下列方法中合适的是( )
(A)先加入稀盐酸,再加入适量硫酸
(B)先加入适量Na2SO4溶液,再加入适量KCl溶液
(C)先加入适量硫酸铁溶液,再加入适量BaCl2溶液
(D)先加入适量BaCl2溶液,再加入适量硫酸铁溶液
8. 若将含有盐酸的MgCl2溶液中和到中性,在不用指示剂的条件下,加入的试剂可以是①氨水 ②碳酸镁 ③氧化镁 ④氢氧化钠 ⑤碳酸钙中的( )
(A)①④ (B)②⑤ (C)②③ (D)④⑤
9. 除去CaO中混有的少量CaCO3,方法正确的是( )
(A)加足量水,充分搅拌后过滤 (B)加足量盐酸、充分反应后过滤
(C)对混合物加强热煅烧
(D)加入足量的Na2CO3溶液,反应后过滤
10.对下列各组物质:①NaNO3和NaCl ②CaCl2和CaCO3
③MnO2和KCl ④BaSO4和AgCl
可按照溶解、过滤、蒸发的实验操作顺序,将它们相互分离开的是( )
(A)只有① (B)③和④ (C)②和③ (D)②和④
11.要除去氯化锌晶体中混有的少量氯化铜和碳酸钙,下列方法中正确的是( )
(A)加水溶解,加入适量AgNO3溶液,反应后进行过滤,蒸发
(B)加水溶解,加入适量锌粉,充分反应后进行过滤、蒸发
(C)加水溶解,加入适量碱溶液,充分反应后进行过滤、蒸发
(D)加水溶解,然后进行过滤、蒸发
12.下列除去杂质的作法正确的是( )
(A)用NaOH溶液除去CO2中混有的氯化氢气
(B)用BaCO3除NaNO3溶液中混有的Na2SO4
(C)用熟石灰的饱和溶液除去燃煤烟气中的SO2
(D)用稀硫酸除去铝壶中的水垢(主要成份为Mg(OH)2、CaCO3)
13.要除去N2中混有的O2、H2、CO2及水蒸气等,可将混合气体依次通过下列各组物质(假设每步除去杂质是完全的),其中能达到目的的一组是( )
(A)澄清石灰水、浓硫酸、灼热的氧化铜、灼热的铜网
(B)灼热的铜网、澄清的石灰水、浓硫酸、灼热的氧化铜
(C)灼热的铜网、灼热的氧化铜、浓硫酸、澄清的石灰水
(D)灼热的铜网、灼热的氧化铜、澄清石灰水、浓硫酸
14.除去HNO3中混有的少量H2SO4,可加入 ;除去铜粉中含有的少量锌粉,可加入 或 ;除去CuO中混有的少量“铜绿”,操作方法为 。
15.简要说明如何除去NaNO3晶体中混有的少量Mg(NO3)2而得到较纯净的NaNO3晶体。
专题四 溶液中的离子共存问题
一、选择题(单、双选都有)
1.在无色溶液中,能大量共存的一组离子是( )
A.H 、Ag 、Na 、 ![]() B.H 、Na 、Cl-、
B.H 、Na 、Cl-、 ![]()
C.H 、Na 、Cl-、 ![]() D.Na 、Cu2 、
D.Na 、Cu2 、 ![]() 、Cl-
、Cl-
2.某种溶液里含k 、Cu2 、sa2-、Al3 和Cl-,则该溶液中的溶质至少有( )
A.2种 B.3种 C.4种 D.5种
3.测得某溶液中含Cu2 、K 、 ![]() 、Cl-四种离子,且阳离子的个数比为Cu2 :K =3:4,则
、Cl-四种离子,且阳离子的个数比为Cu2 :K =3:4,则 ![]() 与Cl-的个数比可能是( )
与Cl-的个数比可能是( )
A.3∶2 B.1∶3 C.1∶8 D.2∶5
4.下列各组中的离子,在pH<7的溶液中可大量共存的是( )
A.Ba2 、Mg2 、 ![]() 、
、 ![]() B.
B. ![]() 、Na 、Cl-、OH-
、Na 、Cl-、OH-
C.K 、 ![]() 、
、 ![]() 、
、 ![]() D.Fe3 、Al3 、Cl-、
D.Fe3 、Al3 、Cl-、 ![]()
5.下列各组离子,不能在溶液中大量共存的是( )
A.Na 、Cu2 、 ![]() 、Cl- B.Ca2 、Na、
、Cl- B.Ca2 、Na、 ![]() 、OH-
、OH-
C.Mg2 、K 、 ![]() 、Cl- D.H 、Ba2 、
、Cl- D.H 、Ba2 、 ![]() 、
、 ![]()
6.某工厂排放的污水中可能含Ba2 、K 、OH-、Cl-、 ![]() 、
、 ![]() 等离子
等离子
(1)取污水仔细观察,呈无色透明,均一状态
(2)取少许污水滴加稀H2SO4产生大量的色沉淀,再加稀HNO3,无大变化
(3)用pH试纸测试,试纸显深蓝色
综上所述污水中肯定含有的离子是
7.甲、乙两种溶液,分别含有下列八种离子中各不相同的四种离子:
OH-、 ![]() 、
、 ![]() 、Cl-、Ag 、K 、Mg2 、Ca2
、Cl-、Ag 、K 、Mg2 、Ca2
甲溶液可使红色石蕊试纸变为蓝色;甲、乙两溶液相混合,产生白色沉淀,加入稀HNO3,沉淀减少。
甲溶液中的离子是 ,
乙溶液中的离子是 。
8.某溶液仅含有H 、Fe3 、 ![]() 、
、 ![]() 四种离子,已知其中H 、
四种离子,已知其中H 、 ![]() 、
、 ![]() 的个数比为1∶2∶3,H 的个数是0.2N4,那么Fe3 所带的电荷数总数为 。
的个数比为1∶2∶3,H 的个数是0.2N4,那么Fe3 所带的电荷数总数为 。
| |