|
一、选择题
1、在甲、乙、丙、丁四个烧杯内分别放入0.1mol的Na、Na2O、Na2O2和NaOH,然后加入100mL水,搅拌,使固体完全溶于水,则甲、乙、丙、丁溶液溶质的质量分数大小顺序是
A、甲<乙<丙<丁 B、丁<甲<乙=丙
C、甲=丁<乙=丙 D、丁<甲<乙<丙
2、下列物质能使品红溶液褪色的是
(1)干燥的氯气 (2)Na2O2 (3)NaClO (4)活性炭 (5)SO2
A、除(1)以外其它均可 B、只有(1)(3)(5)
C、只有(2)(4)(5) D、全部都可以
3、在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3,将其加热到3000C,经充分反应后,容器内残留的固体是
A、0.5mol Na2CO3和1mol NaOH B、1mol Na2CO3和0.6mol NaOH
C、0.8mol Na2CO3和1mol NaOH D、只有1mol Na2CO3
4、(1)Na2O (2)NaOH (3)Na2O2 (4)Na2SO3 1mol上述固体物质,长期放置在空气中,最后质量增加的是(不考虑潮解因素)
A、(1)=(2)>(3)>(4) B、(1)>(3)>(4)>(2)
C、(2)>(1)=(3)>(4) D、(4)>(2)>(3)>(1)
5、甲试管中盛有0.5mol/L Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L的盐酸7.0mL,慢慢往试管中滴加0.5mol/L Na2CO3溶液10mL,那么甲、乙两试管能产生的CO2物质的量应是
A、甲=乙 B、甲>乙 C、甲<乙 D、无法确定
6、下列叙述正确的是
A、久置在空气中的NaOH溶液,加盐酸时有气体产生;
B、 50mL 12mol/L浓盐酸与足量的MnO2反应,都生成氯气0.15mol;
C、常温下,浓硫酸不与Cu反应,是因为Cu被钝化;
D、少量CO2通入浓的CaCl2溶液中能生成白色沉淀。
7、用1L 1.0mol/L NaOH溶液吸收0.8mol CO2,所得溶液中的CO32-与HCO3-比约是
A、1:3 B、2:1 C、2:3 D、3:2
8、把CO2通入含NaOH 0.8g的碱溶液中,将产物在减压条件下蒸干后,得固体1.37g,则通入CO2的质量是
A、4.4g B、0.88g C、0.66g D、都不是
9、欲观察H2燃烧的焰色,燃气导管口的材料最好是
A、钠玻璃 B、钾玻璃 C、石英玻璃 D、铜管
10、碱金属溶于汞中可形成良好的还原剂“汞齐”。取某种碱金属的汞齐7g与水作用得到2.24L H2(标准状况),并得到密度为r g/mL的溶液1L,此溶液溶质的质量分数为
A、0.8/r% B、0.48/r% C、0.32/r% D、0.7/r%
二、填空题
11、用金属钠制取Na2O,通常采用下法:2NaNO2 + Na = 4Na2O + N2试说明为什么不采用钠在氧气中燃烧而采用此法制取Na2O的原因_______________。
12、现有两瓶无色溶液,一瓶是Na2CO3溶液,一瓶是稀盐酸,不用任何试剂(包括水),试用最简便方法判断之________________________________。
13、在含有35.8g Na2CO3和NaHCO3溶液中,加入1mol/L盐酸700mL,反应完全后可以生成8.96L CO2(标况)。问:
(1)其中________过剩;
(2)溶液中Na2CO3有_________g;
(3)若在上述溶液中加入1mol/L盐酸450mL,反应完全后,在标况下可生成CO2 ___________L。
三、实验题
14、实验室里临时需要用NaOH溶液和CO2来制取纯Na2CO3溶液。已知CO2气体通入NaOH溶液中极易过量生成NaHCO3,且无明显现象。
实验室有下列试剂:(1)未知浓度的NaOH (2)37%的盐酸 (3)37%的硫酸
(4)14%的盐酸 (5)大理石 (6)K2CO3 (7)Cu2(OH)2CO3
实验室有下列仪器:铁架台、启普发生器、量筒、烧杯、橡皮管、玻璃导管、分液漏斗。
已知下表中各物质在常温时的溶解度(g/100gH2O)
Na2CO3
NaHCO3
NaCl
Na2SO4
NaHSO4
NaOH
15.9
8.4
35
35.5
20
40
(1)本实验应选用的仪器:除启普发生器、橡皮管、玻璃导管外,还需要__
_________。
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品(填编号)除(1)外,还需要_______________。
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装可省略)____。
(4)根据给出的溶解度表,求出当NaOH溶液中溶质的质量分数大于多少时,在配制过程中会有晶体析出(写出计算步骤和必要的文字说明)。
15、工业产品碳酸钠中常混有氯化钠,测定碳酸钠质量分数的仪器装置图如图所示。供选用的试剂有:NaOH溶液、饱和石灰水、蒸馏水、浓硫酸、浓盐酸、稀盐酸、硝酸、碱石灰、无水氯化钙、无水硫酸铜、试样(含有少量氯化钠的碳酸钠)。请回答:
(1)各有关仪器中使用的药品及作用:
A._____________,作用___________________;
B._____________,作用___________________;
C._____________,作用___________________;
D._____________,作用___________________;
E._____________,作用___________________;
F的作用_________________________________。
(2)实验步骤(到得到实验数据止):
(a)称量:称试样质量及装有干燥剂的球形干燥管的质量,并纪录数据;
(b) ________________________________________________________;
(c)________________________________________________________;
(d) 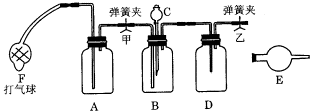
………………………………………………………………………….
四、计算题
16、将某Na2CO3和NaHCO3混合物2.74g加热到质量不再变化时,剩余物质量为2.12g。再称取该样品若干,加入某浓度的盐酸100mL,恰好完全反应,生成CO2672mL(标况),求:(1)混合物中NaHCO3的质量分数;(2)盐酸的物质的量浓度。
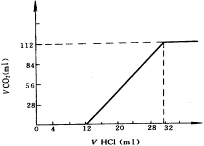
17、今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混和物,取其7.560g与过量的盐酸完全反应,放出CO2体积1.344L(标准状况)。另取等质量的原混和物,加水搅拌,可滤出不溶性盐1.420g。
(1)取过滤后溶液的1/10体积,向其中缓慢滴加浓度为0.2500mol/L的盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到如下图所示的曲线。试计算确定两种碱金属碳酸盐的化学式。
(2)将滤出的不溶性盐(1.420g)投入到浓度为2.500mol/L的盐酸中,当完全反应时,耗去盐酸16.00mL,试计算确定原不溶性碳酸盐的化学式。
18、自然界存在的碳酸盐类铜矿(如孔雀石、石青等)的化学组成为aCuCO3×bCu(OH)2(a,b为正整数,且a£2,b£2)。
(1)将孔雀石、石青矿样分别加盐酸至完全溶解,耗用盐酸物质的量与产生CO2物质的量之比,孔雀石为4:1,石青为3:1。则它们的化学组成为:
孔雀石______________,石青_________________。
(2)今有一分碳酸盐类铜矿样品,将其等分为A、B两份。然后,加盐酸使A样品完全溶解,产生CO23.36L(标准状况);加热B样品使其完全分解,得到20gCuO,试计算并确定矿石的化学组成。
(3)某碳酸盐类铜矿样加酸完全溶解后,产生CO26.72L(标准状况),这份矿样中CuO含量不低于___________g。
(4)设某碳酸盐类铜矿样的质量为Ag,所含CuO质量为Gg。加酸完全溶解后,产生的CO2体积(标准状况)为V L,则含铜矿样的A、V、G之间的关系式为:A=_____________________。
长沙市一中理科实验班(碱金属)考试试题答卷
姓名 __________ 分数 ______________
一、选择题
1
2
3
4
5
6
7
8
9
10
二、填空题
11、原因:___________________________________________________________
___________________________________________________________________。
12、简便方法是:_______________________________________________________
_______________________________________________。
13、(1)_________________;(2)_________________;(3)_________________。
三、实验题
14、(1)
(2)
(3)
(4)
15、(1) A._____________,作用___________________;
B._____________,作用___________________;
C._____________,作用___________________;
D._____________,作用___________________;
E._____________,作用___________________;
F的作用_________________________________。
(2)实验步骤(到得到实验数据止):
(b)_________________________________________;
(c)___________________________________________________;
(d)___________________________________________________;
(e)___________________________________________________;
(f)___________________________________________________;
(注:如步骤未写完,还可再添加)
四、计算题
16、(1)解:
(2)解:
17、(1)解:
(2)解:
18、(1)解:
(2)解:
(3)解:
(4)解:
|