|
一、 选择题
1、 潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,是
因为它们均含有
A、氯气 B、次氯酸 C、次氯酸根 D、氯化氢
2、 某卤素单质X2与热的浓KOH溶液反应生成A、B两种盐,往A盐的浓溶液中加入一定量的另一卤素Y2的水溶液,又可生成X2,且X2不能使淀粉溶液变蓝,则X2、Y2只能是
A、Cl2、I2 B、Br2、I2 C、Cl2、F2 D、Cl2、Br2
4、IBr属于卤素互化物,它的化学性质活泼,其性质与卤素单质相似。它与水反应的化学方程式为:IBr + H2O = HBr + HIO 则下列关于IBr的叙述不正确的是
A、固态的IBr是共价化合物
B、在许多反应中,IBr是强氧化剂
C、在IBr与H2O反应中,IBr既是氧化剂,又是还原剂
D、IBr与NaOH溶液反应,生成NaBr、NaIO和H2O
4、下列物质在空气中久置变质,在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是
A、食盐 B、漂白粉 C、氯水 D、上述选项都不对
5、氟是最活泼的非金属,能体现这个结论的是
A、氢氟酸是弱酸 B、氢氟酸有剧毒
C、NaF是农药 D、氟有XeF2、KrF2等化合物
6、下列化学方程式的配平正确的是
A、2KMnO4 + 11H2S + 5H2SO4 = K2SO4 + 2MnSO4 + 13S¯ + 16H2O
B、2KMnO4 + 8H2S + 4H2SO4 = K2SO4 + 2MnSO4 + 9S¯ + 12H2O
C、2KMnO4 + 5H2S + 3H2SO4 = K2SO4 + 2MnSO4 + S¯ + 4H2O
D、2KMnO4 + 5H2S + 3H2SO4 = K2SO4 + 2MnSO4 + 5S¯ + 8H2O
7、有一种碘和氧的化合物可以称为碘酸碘,其中碘酸根离子中碘呈+5价,则这种化合物的化学式为
A、I2O4 B、I3O5 C、I4O7 D、I4O9
8、氰(CN)2、氧氰(OCN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:
2Fe + 3(SCN)2 = 2Fe(SCN)3 Ag+ + CN- = AgCN¯ 拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱。下列反应式不正确的是
A、2CN- + Cl2 = 2Cl- + (CN)2
D B、(CN)2 + 2OH- = CN-+ CNO-+ H2O
C、(OCN)2 + H2O = 2H+ + OCN- + OCNO-
  D、MnO2 + 4HSCN (SCN)2 + Mn(SCN)2 + 2H2O D、MnO2 + 4HSCN (SCN)2 + Mn(SCN)2 + 2H2O
电解 9、市售家用消毒液发生器是利用常见的精盐和自来水为反应物。通电时,反应器中电解槽内的极板上产生大量的气泡;切断电源后所得消毒液具有强烈的杀菌能力,且对人体无毒。跟该反应器直接有关的化学反应是
A、2NaCl + 2H2O = 2NaOH + H2 + Cl2
B、H2 + Cl2 = 2HCl
C、Cl2 + 2NaOH =NaClO + NaCl + H2O
D、Cl2 + H2O = HCl + HClO
10、砹(At)是原子序数最大的卤素元素,推测砹或砹的化合物最不可能具有的性质是
A、HAt很稳定 B、At易溶于某些有机溶剂
C、AgAt不溶于水 D、砹是有色固体
二、 填空题
11、在化学科学的学习中,对于化学理论、规律等不仅要从正方来支持,而且还要善于从反方来质疑。例如国际公认的气体摩尔体积为22.41383 L/mol,实际上各气体的摩尔体积(见下表)和该数值有偏差,反方以此质疑其正确性。你作为正方,以下哪些条目可作为支持气体摩尔体积的正确性(可以填“Ö”,不可以填“´”)
气 体
摩尔体积L/mol (S.T.P)
H2
22.425
He
22.423
CO2
22.261
HCl
22.249
Cl2
22.063
NH3
22.063
(1) 科学上假定气体分子没有体积大小,没有相互作用的所谓理想状态,科学方法上是合理的。________________
(2) 分析表列分子体积的大小,可说明其偏差。____________
(3) 分析表列分子的相对分子质量,分子极性的差异。____________
(4) 寻找气体摩尔体积的测定方法,资料表明,它在较高温度、较低压强下测定,再用数学外延法获得00C 1atm的数值。__________
12、由两种元素组成的某气体,当质量M=1.2 g时,该气体N=4.5´1022个分子,则该气体的分子式为_______;若1mol该气体完全燃烧能放出890kJ的热量,将该气体完全燃烧放出______kJ的能量,这些热量的50%被500g、200C的水吸收,水温将升至_____0C。已知1相对原子质量单位=1.67´10-27kg,c水=4.2´103J/(kg×0C)。
13、下图为实验室制备少量氯气、氯酸钾及次氯酸钠的简易装置。已知氯气在浓、热碱作用下,发生自身氧化还原反应(称歧化反应)可以得到氯酸盐。氯气在冷、稀碱作用下,发生歧化反应可以得到次氯酸盐。试根据下图回答:
(1) B装置的作用及反应方程式 ___________________________;
(2) C装置的作用及反应方程式 ___________________________;
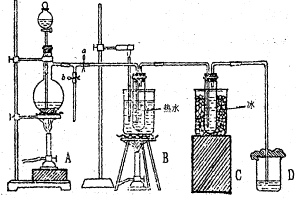 
(3) 如果制备氯气时,实验室中没有二氧化锰,可替代的药品是(指出两种) _____________________________________________;
13题图 14题图
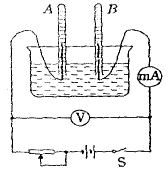
14、如右上图所示为电解水的实验装置,闭合开关S后,观察到电压表的示数为6.0V,毫安表的示数为100mA。
(1) 此时A管内生成_______气,B管内生成______气;
(2) 试写出电解水的化学反应方程式 ________________________;
(3) 已知在通电过程中,离子的氧化性或还原性强的首先在电极上放电,A电极的化学反应是___________________,B电极的化学反应是_______________;
(4) 在实验过程中消耗了________形式的能量,产生了________形式的能量;
(5) 若通电10分钟,A管中将生成__________mL气体;
(6) 已知每摩尔水被电解消耗280.8kJ能量,则10分钟内增加了______ kJ的化学能;
(7) 在电解池中产生________kJ的内能,在该实验中两极间液体的电阻是__________W;
(8) 在电解中常常加入某些电解质以增强水的导电性。为保证溶质不从溶液中析出而附着在电极上增大电阻,必须不断往电解池中滴入纯水,保证此温度下的溶液的饱和状态。若氢气流量保持在0.1 L/s(折合成标准状态),则滴入水的滴速是____________mL/s 。
15、KMnO4溶液(未酸化)跟FeSO4溶液混合,还原出MnO2,则该反应的方程式为______________________________________;
16、宇航员在研究某星球的大气时,测知其主要成分是一种易溶于水的气体A;用酸化的KMnO4溶液与A的水溶液共热时,可获得一种棕色气体产物B,B冷至室温时,即凝为液体;B与碱反应能生成两种盐。据此推断:大气主要成分A是_________,它与KMnO4溶液反应的方程式为_________________________
_______________________________________________________________;
三、 实验题
17、氯水中含有Cl2、HCl和HClO三种物质。请你设计一个实验证明之。要求写出主要的实验仪器和简明的实验步骤。
18、某学生拟用250 mL容量瓶、35 cm长的玻璃导管作HCl的喷泉实验后,再作SO2的喷泉实验;经测知:喷泉实验中的胶头滴管每次能挤出0.5mL的水。请通过计算说明:若该同学在准确操作的情况下,他的SO2的喷泉实验能否成功?已知常温常压下,1体积水能溶解40体积的SO2 。
四、 计算题
19、在密闭容器中盛三种气体混合物,使其爆炸,如果第一种气体是用21.45g Zn同500g 37%的盐酸反应制得的;第二种气体是用分解25.5g NaNO3制得的(已知NaNO3受热分解得NaNO2和使带火星的木条复燃的气体);第三种气体是用MnO2和浓HCl反应制得的(已知浓HCl中被氧化的HCl气体的量为2.19g)。求爆炸后生成酸溶液的质量分数是多少?
20、在一个污水处理厂中,用生物方法处理污水。在废水藻所含糖类(CH2O)n杂质里,有45%被完全氧化,另有10%经发酵过程进行无氧分解,生成两种化合物,其余沉淀仍留在沉积物中。若该厂每天一共可产生16 m3的气体(250C、100kPa) 试回答:
(1) 写出化学反应方程式
(2) 每天有多少糖类留在沉积物中?(按kg/日计)
(3) 通过燃烧生成的甲烷,每天可产生多少热能?(燃烧热为882kJ/mol)
21、1200C、101.3kPa条件下,有2 L H2O、2 L CO、1 L CO2、0.5 L O2和1 L H2组成的混合气体。将混合气体通过分别放有足量的Cu粉、C粉和CuO粉的三个灼热的反应管。假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列。问:
(1) 尾气中是否有可能是单一气体?若可能,该气体是什么?
(2) 原气体中是否有几种或一种不可能再存在于尾气中?若有,它们是什么?
(3) 原气体中是否有几种或一种肯定存在于尾气中?若有,它们或它是什么?
长沙市一中理科实验班(卤素)考试试卷
答 题 卷
姓名_______ 分数______
一、选择题
1
2
3
4
5
6
7
8
9
10
二、填空题
11、(1)__________ (2)_________ (3)________ (4)__________
12、分子式 __________ _________kJ _________0C
13、(1)_____________________________________________________
(2)_____________________________________________________
(3)_____________________________________________________
14、(1)A管_____________,B管________________
(2)____________________________________________________
(3)消耗 ________能量;产生 __________能量
(4)A电极反应式 __________________________________
B电极反应式 __________________________________
(5)__________ mL
(6)_________________kJ
(7)________________kJ _______________W
(8)________________mL/s
15、_____________________________________________________
16、A _____________;反应式 ______________________________
三、实验题
实验仪器:
实验步骤:
17、
解: 18、
五、 计算题
解: 19、
20、

21、
(3)
摘自化学试题集
|