|
一、选择题
1、下列叙述中错误的是
A.消除散落在地上的汞珠的方法是撒上硫粉;
B.铜丝擦亮后伸入到硫蒸气产物是CuS;
C.可以用CS2浸泡的方法除去附在玻璃器皿上的硫;
D.可以用加热浓NaOH溶液除去附在试管内壁上的硫;
2、为方便某些化学计算,有人将98%的浓H2SO4表示成下列形式,其中合理的是
A. H2SO4×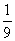 H2O B. H2SO4×H2O H2O B. H2SO4×H2O
C. H2SO4×SO3 D. SO3×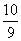 H2O H2O
3、在氧气流中灼烧0.22g某种铁和硫的化合物,使其中硫全部转化为SO2,把所有的气体通入过量的氯水和BaCl2的混合溶液中,得到BaSO4沉淀0.005mol。则原混合物中硫的质量分数为
A. 82% B. 36.5% C. 73% D. 53%
4、Cl2和SO2皆可作漂白剂,混合使用后,其漂白效果会
A. 增强 B. 不变 C. 减弱 D. 难以确定
5、在下列物质中,既能跟H2S反应,又能跟溴水反应的是
1) Na2S溶液 2)SO2饱和溶液 3)CuSO4溶液 4)AgNO3溶液
A. (2)(4) B. (1)(3) C. (1)(2)(4) D. (1)(2)(3)(4)
6、已知PbSO4难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液,形成无色溶液,其化学方程式为:PbSO4 + 2NH4Ac = Pb(Ac)2 + (NH4)2SO4;当在醋酸铅Pb(Ac)2溶液中通入H2S时,有黑色的PbS生成。表示这个反应的有关离子方程式正确的是(醋酸HAc是弱酸)
A. Pb(Ac)2 + H2S = PbS¯ + 2HAc
B. Pb2+ + H2S = PbS¯ + 2H+
C. Pb+ + 2Ac- + H2S = PbS¯ + 2HAc
D. Pb2+ + 2Ac- + 2H+ + S2- = PbS¯ + 2HAc
7、G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平)
(1) G®Q + NaCl (2) Q + H2O X + H2 X + H2
(3) Y + NaOH®G+Q+H2O (4) Z+NaOH®Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序是
A. QGZYX B. GYQZX C. GYZQX D. ZXGYQ
8、把112mL Cl2 (标准状况)通入10mL 1mol/L的FeBr2溶液中,发生反应的离子方程式书写正确的是
A. Cl2 + 2Br- = 2Cl‑ + Br2
B. Cl2 + 2Fe2+ = 2Cl- + 2Fe3+
C. 2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + Br2 + 4Cl-
D. 2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
9、将放射性的同位素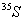 与非放射性的Na2SO3溶液一起加热煮沸可得Na2S2O3。若将所制得的Na2S2O3酸化,又可得到含放射性硫的沉淀,而逸出的气体SO2无放射性。这表明: 与非放射性的Na2SO3溶液一起加热煮沸可得Na2S2O3。若将所制得的Na2S2O3酸化,又可得到含放射性硫的沉淀,而逸出的气体SO2无放射性。这表明:
A. 两种硫之间没有发生交换作用
B. 在Na2S2O3内部两个硫原子等价
C. 在Na2S2O3内部两个硫原子不等价
D. 在合成Na2S2O3时,放射性硫作还原剂
10、PbO2微热时可分解成PbO和O2。PbO是一种不溶于水但易溶于酸的黄色物质。把适量黑褐色PbO2粉末投入热水,一边搅拌,一边通入SO2气体,结果得到白色不溶物。对此做出的判断错误的是
A. PbO2具有氧化性 B. 白色不溶物是PbSO3
C.白色不溶物是PbSO4 D. 白色不溶物既是氧化产物,又是还原产物
二、填空题
11、为了保护环境,变害为利,工业上常用纯碱吸收有害气体,同时得到NaHSO3,该反应的离子方程式为________,从这一个反应可见H2SO3的酸性比H2CO3的酸性________;NaSO3常用于除去漂白织物后剩余的游离氯,该反应的离子方程式为________________。
12、当____________和____________在溶液中反应时,可用下列离子方程式表示:Ca2+ + HCO3- + OH- = CaCO3¯ + H2O
13、已知四种物质在水中、液氨中的溶解度(克溶质/100克溶剂)如下表。这几种化合物在两溶剂中能发生复分解反应的方程式分别是:
(1) 水中化学方程式_____________________;离子方程式_______;
(2) 液氨中化学方程式___________________;离子方程式_______。
类别
AgNO3
Ba(NO3)2
AgCl
BaCl2
水
170
9.3
1.5´10-4
33.3
液氨
86
97.2
0.8
0
14、如图,有直径为3.57cm的U型管,内装有汞。烧瓶内装有足量的稀硫酸,它的橡皮塞除导管外还装有两根铂丝,铂丝可上下移动,且下端系有0.28g铁丝。整个装置密闭性好,装置内空气体积为500mL (O2占1/5),开始反应前U型管中汞面两边相平。现把铂丝全部浸入稀硫酸中,充分反应后,装置内混合气体体积变化了DV1 mL (气体体积均在标况下测定)。然后再用电火花反复多次引燃装置内的气体,充分反应后,恢复至标况,测得装置内气体的体积与原始空气的体积差为DV2 mL (假设反应前后烧瓶中溶液的体积不变,且DV1、DV2只取绝对值)。
(1) 电火花反复引燃后,U型管内的液面_____(填左或右)边高;
(2) DV1、DV2间的关系式为_______________;
(3) 电火花引燃前U型管中液面的高度差为______cm;
(4) 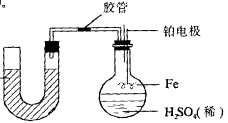
其他条件不变,欲使电火花引燃后,U型管中汞面左边高,则铁丝质量的取值条件是_____________。
三、实验题
15、三个学生设计了下述三个实验方案,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中含有SO42-。
方案甲:试液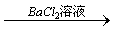 白色沉淀 白色沉淀 沉淀不溶解 沉淀不溶解
方案乙:试液 无沉淀 无沉淀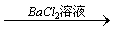 白色沉淀 白色沉淀
方案丙:试液 无沉淀 无沉淀 白色沉淀 白色沉淀
试评价上述三种方案是否严格,并分别说明理由。
16、以中学常备实验器材,设计一个实验证明氢氧化钡溶液和稀硫酸的反应为离子反应。要求写出实验原理、实验器材、实验步骤。
四、计算题
17、将H2S和O2组成的混合气体放入2000C,压强稍低于1atm的密闭容器中燃烧,反应结束后,使其恢复到开始温度,压强较开始降低了 28.6%,然后向容器中通入80g氧气,再在高温下燃烧,当冷却到2000C后,容器中压强变为开始的1.43倍。若已知反应后混合物中还剩余氧气,试求开始时组成混合气体的各物质的物质的量。
18、下图是现今常规的生产发烟硫酸和硫酸的流程简图。试回答
1、在(1)处投入的液态原料是什么?
2、在(2)处发生15000C的“不完全燃烧”,即先混入少量的干燥空气,然后再在(3)处于7000C下再发生继续燃烧。试说明,为何这种燃烧方式对环境保护是有利的?
3、在(4)处SO2被催化氧化成SO3。试问:为使SO3的产率高,该处应取等温过程还是绝热过程为宜?
4、为何二次催化炉(7)是必需的?
5、(5)处的气体混合物主要是N2和SO3。为什么气体混合物通过吸收塔(6)后不立即通入二次催化炉?
6、若该工厂催化炉“出口气体”中含有N2、O2、少量SO2和10%(体积)的SO3,把出口气体送进吸收塔,使SO3转化为98%(质量)的硫酸和发烟硫酸[是硫酸和三氧化硫的混合物,其中含20%(质量)的三氧化硫]
(1) 若该工厂只生产发烟硫酸,试计算:(a) 计算1000m3出口气体中所需要水的质量(T=273K,P=101.3KPa);(b) 算出每1000m3出口气体在上述条件下生产的发烟硫酸的质量;
(2) 若该工厂只生产98%的硫酸:(a) 计算1000m3出口气体中所需要水的质量(T=273K,P=101.3KPa);(b) 算出每1000m3出口气体在上述条件下生产的98%硫酸的质量;
(3) 若该工厂同时生产发烟硫酸和98%硫酸(两种产物的质量比x=m1/m2,m1和m2分别是发烟硫酸和98%硫酸的质量)
(a) 导出数学表达式,用来描述每1000m3出口气体中所消耗水的质量同上述x间的关系。
(b) 
说明问题(1)和问题(2)中得到的有关数据是否符合你导出的数学表达式。
长沙市一中理科实验班(硫 硫酸)考试试题答卷
姓名___________ 分数___________
一、选择题
1
2
3
4
5
6
7
8
9
10
二、填空题
11、离子方程式______________________________________;_____;
离子方程式______________________________________。
12、___________和________________。
13、(1)在水中化学方程式___________________________________;
离子方程式_______________________________________。
(2)在液氨中化学方程式________________________________;
离子方程式_______________________________________。
14、(1)_____________________;(2)________________________;
(3)_____________________;(4)_________________________。
三、实验题
15、甲方案__________________________________________________
________________________________________________;
乙方案_________________________________________________
________________________________________________;
丙方案_________________________________________________
________________________________________________;
16、实验原理_______________________________________________
________________________________________________;
实验器材_______________________________________________
________________________________________________;
实验步骤______________________________________________
__________________________________________________
________________________________________________。
四、计算题
17、解:
18、解:
|