|
姓名________ 分数______
说明:本卷可能用到的相对原子质量为:C~12 H~1 N~14 O~16 S~32 Cu~63.5 P~31 Zn~65 Al~27 Fe~56 Mg~24 Ba~137 B~11 F~19 Cl~35.5
一、 选择题
1、在标准状况下,体积相同的下列几种物质中,组内各物质的分子数相同的是
A、N2 和O2 B、H2和PCl3 C、O2和PCl5 D、无答案
2、在标准状况下,将CO2、N2、O2、SO2混合,混合气体的平均相对分子质量为
A、28 B、32 C、在42~64之间 D、在28~64之间(不含28和64)
3、任何气态物质,在同温同压下,如果物质的量相同,则它们的
A、体积都约等于22.4L B、体积相同 C、质量相同
D、密度不一定相同 E、分子数不相同
4、在标准状况下,氢气和氧气混合气体A L,引爆后冷却至原状态时,体积减少至B L,则在原混合气体中氢气体积可能是
A、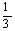 (2A+B) L B、 (2A+B) L B、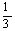 (A+2B) L C、 (A+2B) L C、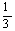 (A+B) L D、 (A+B) L D、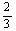 (A-B) L (A-B) L
5、一个塑料瓶空着的时候是42.6473 g,装满500mL水(d=1g/mL)时的质量是542 g,标态时装满待测气体的质量是45.4375g,待测气体的相对分子质量为
A、71 B、28 C、154 D、44 E、64
6、某混合气体的成分是CO和N2,经测定它的密度为1.25g/L,则CO在混合气体中的体积分数是
A、25% B、50% C、75% D、任意体积比
7、0.1mol红磷在一定量的Cl2中燃烧,其质量增加15g,所生成的物质是
A、PCl3和PCl5 B、PCl3 C、PCl5 D、等摩尔的PCl3和PCl5
8、40C时某一滴管滴出30滴水,体积为a mL,则每滴水中所含的水分子数为
A、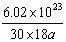 B、 B、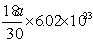 C、 C、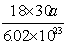 D、 D、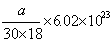
9、向盛有同物质的量浓度、等体积盐酸的两烧杯中,分别加入m g Fe和Zn,当反应停止后,其中一杯残留少量金属,则杯中HCl(氯化氢)的物质的量估计为
A、m/32.5 mol B、m/28 mol
C、m/32.5 mol < n(HCl)< m/28 mol D、m/32.5mol £ n(HCl)< m/28 mol
10、若30g密度为d g/mL的AlCl3的溶液中含有0.9g Al3+(不考虑Al3+与水反应),则Cl-浓度为
A、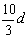 mol/L B、 mol/L B、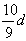 mol/L C、 mol/L C、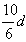 mol/L D、 mol/L D、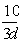 mol/L mol/L
11、体积为1L的干燥容器中,充入HCl气体后,测得容器中气体对氧气的相对密度为1.082,用此气体进行喷泉实验,当喷泉停止后,进入容器中液体的体积为
A、0.25 L B、0.5 L C、0.75 L D、1L
12、配制物质的量浓度的溶液,造成浓度偏高的操作是
A、溶解后的溶液未冷至室温就转入容量瓶中;
B、 洗涤烧杯和玻棒的溶液未转入容量瓶中;
C、定容时眼睛俯视刻度线;
D、定容时眼睛仰视刻度线;
13、在标准状况下,氧气的溶解度为0.049,则相同状况下,100mL水中可溶解氧气
A、0.0049 B、0.049 C、0.49 D、0.007
14、假定把12C的相对原子质量改为24(NA代表阿佛加德罗常数),则下列推断中不正确的是
A、此时16O的相对原子质量为32;
B、 标准状况下,44g CO2的体积为22.4 L;
C、NA个氧分子与NA个氢分子的质量比是16:1;
D、44g CO2和28g CO含有相同数目的分子;
15、用NA表示阿佛加德罗常数,下列说法正确的是
A、水的摩尔质量等于NA个水分子的式量之和;
B、 在标准状况下,11.2 L 氖气含有NA个氖原子;
C、有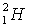 和 和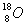 所组成的水11g所含中子数为6NA; 所组成的水11g所含中子数为6NA;
D、SiO2晶体中,每摩尔硅原子与2NA个氧原子形成共价键;
二、 填空题
16、某物质A在一定条件下加热分解,产物都是气体,分解方程式为:2A=B+2C+2D,测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为____________________。
17、V2O3和V2O5按不同物质的量之比混合可按计量发生完全反应:x V2O5 + y V2O3 ® z VnO2n+1。试问:为制取V6O13、V3O7及V8O17,反应物的物质的量之比分别是________、 ________、 ____________。
18、已知A、B两元素的单质气体在同温同压下能以2:1体积比完全化合成C的气体,且反应后的气体比反应前气体体积减少1/3,则可证明B元素的单质气体一定不是______(填单原子或双原子)分子。
19、1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”参照它回答:
已知热化学反应方程式:C(固、金刚石) + O2(气) = CO2(气) +395.41 kJ
C(固、石墨) + O2(气) = CO2(气) +393.51 kJ。则金刚石转化成石墨时的热化学方程式为_________________________________________;由热化学方程式看来更稳定的碳的同素异形体是___________________。
20、在标准状况下,a L H2和Cl2的混合气体经光照引爆,所得气体恰好能使b mol NaOH变成盐,则a、b的关系是_______________________________。
三、 实验题
21、某学生试图用电解法根据电极上析出物质的质量来验证阿佛加德罗常数值,其实验方案的要点为:
A、 用直流电电解CuCl2溶液(生成Cu和Cl2),所用仪器如下图:
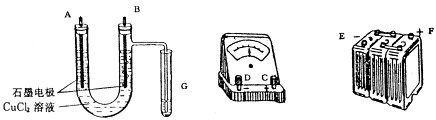
B、 在电流强度为I安培,通电时间为t秒钟后,精确测得某电极上析出的
铜的质量为m g。试回答:
(1) 连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同):
E接_________,C接________,___________接F。实验线路中的电流方向为_____® ____ ® ____® ______ ® _____ ®____
(2) 写出上述电解反应的化学方程式______________________;G试管中淀粉KI溶液变化的现象是________________________,相应的化学方程式为_____
______________________________________________。
(3) 为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应为______
__________________________。(选填下列操作步骤的编号)
a、称量电解前电极质量 b、刮下电解后电极上的铜并清洗
c、用蒸馏水清洗电解后电极 d、低温烘干电极后质量
e、低温烘干刮下的铜后质量 f、再次低温烘干后称量至恒重
(4) 已知电子的电量为1.6´10-19库仑。试列出阿佛加德罗常数的计算表达式:
NA = ______________________________________________________
22、在室温和充分搅拌下,将不同体积的盐酸和氢氧化钠溶液混合。以下各混合物所达到的最高温度,结果如下:
        盐酸的体积(mL) 盐酸的体积(mL)
5 10 15 20 25 30 35 40 45
NaOH溶液的体积(mL)
45 40 35 30 25 20 15 10 5
最高温度(0C)
22.4 24.4 26.6 28.8 28.6 26.8 25.0 23.4 21.6
(1) 绘出最高温度与盐酸体积的关系图(绘在给定的坐标图上)
(2) 写出反应方程式:______________________________________________。
(3) 为使温度上升至最大可能的数值,须将_______mL盐酸和______mL NaOH溶液混合。
(4) 为得到刚好中性的溶液,须将______mL盐酸和_____mL NaOH溶液混合。
(5) 把10mL盐酸和40mL NaOH溶液相互混合,所得溶液中有_______________
离子存在。
四、 计算题
23、已知难溶物BaCO3在常温下的溶解度是9´10-5 mol/L,试计算在100g水中溶解的BaCO3的质量。
24、NiO晶体在氧气中加热,部分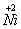 被氧化成 被氧化成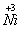 而成为NixO(x<1)。该晶体为NaCl型晶体,晶体的基本单元为立方体,每个立方体中含有4个NixO分子。今有一批NixO晶体,测得密度为6.47 g/cm3,立方体的边长为0.4157´10-7cm。 而成为NixO(x<1)。该晶体为NaCl型晶体,晶体的基本单元为立方体,每个立方体中含有4个NixO分子。今有一批NixO晶体,测得密度为6.47 g/cm3,立方体的边长为0.4157´10-7cm。
(1)
+3
+2 求NixO的相对分子质量;
(2) 已知Ni原子的相对原子质量为58.70,当NixO以NiyNizO表示时,求y、z值。
25、元素X能分别和B、N及O形成二元化合物。在二元化合物中B占16.2%,N占19.7%,O占29.7%,其摩尔质量分别为54、68、71g/mol(未按顺序),在各未知物具体摩尔质量下能否知道X是何种元素?若能,请确定X并给出各化合物的分子式。
|