| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
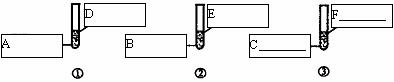
根据上述数据分析,实验4得到的溶液属于_________溶液(填“饱和”或“不饱和”)。该温度下KNO3的溶解度是____________g。 21.(3分)实验室现有下列药品:盐酸(5%)、硫酸(5%);大小相同的镁片、铝片、铁片;铁粉、铝粉。某同学为了比较金属与酸的反应,按下图所示的实验方案进行实验。
从实验开始到反应5分钟,所观察到的现象记录如下:
| 编号
| ①
| ②
| ③
| 现象
| 金属表面立即有大量无色气泡冒出,反应不到5分钟金属已消失
| 金属表面慢慢有少量无色气泡冒出。反应到5分钟时,铝片还在冒气泡
| 铁粉中不断有无色气泡冒出。气泡的量比②中多,溶液逐渐显浅绿色,反应到5分钟时,铁粉还在冒气泡 |
该同学根据上述实验现象得出结论:金属与酸反应的剧烈程度按镁、铁、铝的顺序减弱。
你认为该同学的结论是否合理(填“合理”或“不合理)_______________,假如有不合理的地方,请你在上述设计的基础上完善该实验,在下图6个方框中填写所需的化学药品;假如合理,可以不填。
22.(2分) 认真分析下列各组物质,每组中都有一种物质与其他物质所属类别不同,请在下面横线上填写这种物质的化学式:
(1)水、氧化铜、 水银、三氧化硫 ;
(2)硫酸铜、硝酸、氯化锌、硝酸银 。
四、(本题包括4小题,共22分)
23.(本题有a、b两小题,考生任选一题解答,不得两题都解。若两题都解,则以a小题计分)
我解答 小题 (请在横线上填写题号“a”或“b”,以确认你的选择)。
a.(4分)某校食堂中餐食谱如下:
主食:大米饭
配菜:红烧排骨 煎鸡蛋 炸鸡腿 豆腐汤 炒猪肝
主食和配菜中主要含维生素、__________、_________、__________、无机盐和水等营养素, 考虑到各种营养成分的均衡搭配,应该增加的配菜是_____________。
b.(4分)亲爱的同学,还有一个多月你就要初中毕业了。离开母校之际,你要留下最后一个好印象,做到爱护学校的一草一木,不乱扔东西……假设你在整理自己的东西时,清理出如下物品:A、废作业本,B、烂苹果,C、易拉罐瓶,D、霉变了的饼干,E、生锈的铁钉。
(1)你应放入“可回收垃圾箱”的是 (填字母代号);
(2)你可用盐酸除去铁钉上的铁锈(主要成分是Fe2O3),以重新使用,请写出除锈的化学方程式: 。
(3)请你写一句劝告其他年级同学爱护学校环境的话语: 。
24.(8分)下图是实验室制取气体的一些装置,据图回答有关问题。(友情提示:以下所选装置均填装置序号)
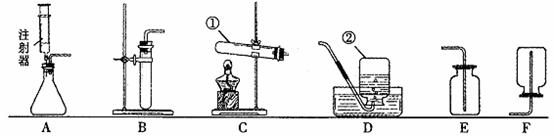
(1)写出指定仪器的名称:① ;② ;
(2)写出一个初中化学中可用装置C制气体的化学方程式 ;
该装置中试管口略向下倾斜的原因是 ;
(3)收集(2)中所得气体可选用的一种装置是 ,利用该装置还能收集的一种气体是 ;
 (4)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水的速度,以免剧烈反应放热引起发生装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是 ;假如用右图所示装置收集乙炔,气体应从 (填“a”或“b”)端管口通入。
(4)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水的速度,以免剧烈反应放热引起发生装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是 ;假如用右图所示装置收集乙炔,气体应从 (填“a”或“b”)端管口通入。
25.(4分) 在2008年北京奥运场馆的建设中,外墙体将大量采用新型塑料膜材料ETFE [ ETFE的化学名称为: 聚氟乙烯,化学式为:(C2H2F2)n ],这种材料美观、耐用,且无须清理维护,可以使用15至20年。请回答下列问题:
(1)ETFE由 种元素组成; ETFE中C、H、F元素的质量比为(填最简整数比) 。
(2)ETFE中C元素的质量分数为 。(计算结果保留一位小数,要写出计算过程)
|
pH |
|
7 |
|
V/mL |
|
24.5 |
|
O |
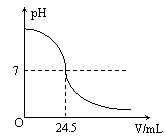 26.(6分)利用中和反应可以测定酸或碱溶液中溶质的质量分数。例如,在一定量的待测酸(或碱)溶液中逐滴滴入已知质量分数的碱(或酸)溶液(这种溶液被称为标准溶液),直到酸、碱恰好完全反应,根据消耗标准碱(或酸)溶液的多少即可求算出待测酸(或碱)溶液的溶质质量分数。
26.(6分)利用中和反应可以测定酸或碱溶液中溶质的质量分数。例如,在一定量的待测酸(或碱)溶液中逐滴滴入已知质量分数的碱(或酸)溶液(这种溶液被称为标准溶液),直到酸、碱恰好完全反应,根据消耗标准碱(或酸)溶液的多少即可求算出待测酸(或碱)溶液的溶质质量分数。
右图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图。
(1)根据右下图曲线可以判定在实验中是向 (填“酸”或“碱”,下同)溶液(待测液)中滴加 溶液(标准液)。
(2)在这次测定中,为了指示中和反应刚好完全,用酚酞做指示剂,即在待测溶液中先滴入几滴酚酞试液,若看到 现象,则证实中和反应刚好完全。
(3)假如实验中使用的酸是硫酸溶液,碱是氢氧化钠溶液,且待测液和标准液的密度均以1.0g/mL计。若测定中取用待测液25mL,标准液溶质的质量分数为4.5%,根据图中数据,计算待测液溶质的质量分数。
五、(本题包括4小题,共24分)
27.(6分)[查阅资料]知:
(1)在有机化学以碳、氢两种元素组成的环状化合物中,从含三个碳原子到含十个碳原子的碳、氢化合物都按丙、丁、戊、己、庚、辛、壬、癸来标记碳原子数,并根据碳原子数命名为“环某烷”,如环丙烷,其化学式为C3H6,结构式如下图(1),也可简写为下图(2)。现在一种由碳、氢两种元素组成的有机环状化合物,其结构式简写成下图(3),该种物质的名称是 ,其化学式是 。
![]()
(1) (2) (3) (4)
(2)苯是一种有机物,化学式为C6H6 ,是一种液体,有毒,不溶于水,密度比水小,熔点5.5℃,沸点80.1℃。在空气中完全燃烧生成CO2和H2O,不完全燃烧时还生成CO。
请完成以下 = 1 * GB3 ①、 = 2 * GB3 ②两个问题:
= 1 * GB3 ①写出苯在空气中完全燃烧的化学方程式: ;在该化学反应中:在相同条件下生成水蒸气与二氧化碳体积比v(H2O):v(CO2)= 。
= 2 * GB3 ②苯的熔点比较低,在低温时很轻易凝固成冰一样的晶体。若苯凝固,如何从试剂瓶(细口瓶)中取出苯?答: 。
28.(3分)右图是 A、B、C三种物质的溶解度曲线。请回答: 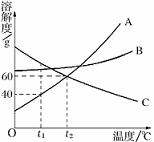
(1) ![]() ℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
(2)当B中混有少量A时,可用 方法提纯B;
(3)在 ![]() ℃时,将25 g A物质加入到盛有50 g水的烧杯中,充分搅拌,再升温至
℃时,将25 g A物质加入到盛有50 g水的烧杯中,充分搅拌,再升温至 ![]() ℃(不考虑溶剂的挥发),在升温过程中,A溶液中溶质的质量分数的变化情况是 。
℃(不考虑溶剂的挥发),在升温过程中,A溶液中溶质的质量分数的变化情况是 。
29.(10分) 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术。他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。小军很爱好,于是,他和同学们进行探究:
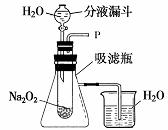 [提出问题] 过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[提出问题] 过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[猜想] ① 可能有一种气体和另一种物质生成
② 反应过程中可能有能量变化
[设计装置] 如右图所示
[实验探究]
实验一:探究反应后生成的气体是什么?
(1)打开右图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃。说明生成的气体是 。
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,
请解释产生该现象的原因: 。
实验二:继续探究反应后生成的另一种物质是什么?
(1)小张猜想另一种物质是Na2CO3,小军认为不可能。小军的依据是: 。
为了证实小军的看法,请你设计一个证实CO32-不存在的实验。
实验步骤
实验现象
实验结论
(2)小军取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的溶液呈 性。
[表达] 根据实验探究的结果:写出过氧化钠和水反应的化学方程式: ,其中过氧化钠中氧元素的化合价为 价。
30.(5分) 某校化学爱好小组经查阅资料得知:铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域。铝亦有其非凡的性质: = 1 * GB3 ①铝的熔点是660℃,氧化铝的熔点高达2054℃。 = 2 * GB3 ②铝虽比锌活泼,但是将铝片和锌粒分别投入稀硫酸中,铝比锌反应慢得多。 = 3 * GB3 ③尽管铝表面致密的氧化膜能使铝与其四周的介质(空气、水)隔绝,但“希奇”的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组进行了“铝表面氧化膜”的实验,其过程如下,并请完成填空:
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗片刻后变软;轻轻摇动,会左右摇摆,却不像蜡烛那样滴落。这是因为 ,所以不易发生熔滴现象。试写出灼烧铝的化学方程式: 。
(2)取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中,其表面很快析出较多红色粉末状固体;而另一片浸入CuSO4稀溶液中现象一直不明显。试猜测产生这种现象差异的因素是 。
(3)用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,直到2~3分钟后,铝片表面才有少量红色固体附着。试写出铝片表面附着红色固体的化学方程式: ___________。
(4)向步骤(2)的CuSO4稀溶液中滴入3~5滴NaCl稀溶液,铝片表面逐渐有红色固体析出。
(5)向步骤(2)的CuSO4稀溶液中滴入3~5滴Na2SO4稀溶液,铝片表面现象一直不明显。
因此据步骤(2)、(3)、(4)、(5)的现象可以得出的结论是___________________________。
初三下学期模拟测试
化学试卷
参考答案
一、选择题(每小题2分,共30分)
1.D 2.B 3.D 4.D 5.B
6.C 7.A 8.C 9.B 10.C
11.B 12.B 13.D 14.D 15.C
二、(本题共4小题,共16分)
16.(6分)每空1分①Fe ②2O2 ③SO42- ④Mg(NO3)2 = 5 * GB3 ⑤ NH3 • H2O = 6 * GB3 ⑥ Al2O3
17.(1)酒精(1分),葡萄糖(1分);(2)CaO H2O=Ca(OH)2. (1分)化合(1分)
18.(每空1分,共4分)(1) ④(1分);②(1分);①(1分);(2)漏斗(1分)
19.(每空1分 共2分) MnCl2 ; 氯化氢
三、(本题共3小题,共8分)
20.( 共3分)饱和(1分);110(2分)
21.(共3分)不合理(1分) A、B、C均为片状的镁、铁、铝得1分;D、E、F为稀盐酸或稀硫酸中同一种酸得1分
22.(共2分)(1)Hg (1分)
(2)HNO3(1分)
四、(本题包括4小题,共22分)
23.a (每空1分 共4分)糖类;蛋白质;油脂;蔬菜
b (共4分)(1)A、C、E (三个全对得2分,三个中对2个得1分,有错误选项不得分) (2)Fe2O3 6HCl == 2FeCl3 3H2O(1分)
(3)爱护环境,人人有责;爱护我们共同的家;小草也有生命,请勿践踏。(1分)
(任写一句,其他合理答案也按标准给分)
24.(共8分)
(1) ① 试管 (1分) ② 集气瓶(1分)
(2)2KMnO4 SHAPE * MERGEFORMAT
|
△ |
(3)D(或E) (1分);H2(或CO2,写名称也可) (1分)
(4)A (1分);b(1分)
25.(共4分)
(1)3 种;(1分) 12:1:19; (1分)
(2) 37.5﹪ (2分)
26.(共6分)
(1) 碱 ;酸 (2空一共1分)
(2)溶液的红色刚好褪去(1分)
(3)消耗掉的硫酸溶液质量:24.5mL×1.0g/mL=24.5g
消耗掉的硫酸溶液中溶质的质量:24.5g×4.5%=1.10g (1分)
解: 设待测液溶质质量分数为x
2NaOH H2SO4 = Na2SO4 2 H2O (1分)
80 98
25 mL×1.0g/mL×x 1.10g (1分)
80 :98 = 25 mL×1.0g/mL×x :1.10g
x=0.036(即3.6%)
答: 待测液溶质质量分数为3.6% (1分)
五、(本题包括4小题,共24分)
27.(共6分)(1)环己烷(1分); C6H12(1分)
(2) = 1 * GB3 ① 2C6H6 15O2 ![]() 12 CO2 6H2O (1分) ;1:2(1分)
12 CO2 6H2O (1分) ;1:2(1分)
= 2 * GB3 ② 将试剂瓶放在温水中(用“手捂一会”也可以),使苯熔化,再将苯倒出(2分)
28.(共3分)(1)C > B> A (1分)
(2)蒸发结晶 (1分)
(3)先逐渐增大,后保持不变(1分)
29.(共10分) 实验一:
(1)氧气(或O2 ) (1分)
(2)过氧化钠与水反应放出热量,使吸滤瓶中的空气受热膨胀,因此伸入烧杯中的导管口看到有气泡产生。(2分)
实验二:
(1)根据质量守恒定律,反应物中没有碳元素,所以生成物中不可能有Na2CO3(1分)取少量反应后所得的溶液于试管中,加入稀盐酸;(1分)没有气泡产生(1分);生成物中没有Na2CO3(1分)
(2)碱 ;(1分)
2Na2O2 2H2O==4NaOH O2↑ (1分); -1价 (1分)
30.(1) 铝表面氧化膜的熔点高于内层铝的熔点并将其包裹住 (1分);
4Al 3 O2 ![]() 2Al2O3 (1分)
2Al2O3 (1分)
(2)氯离子能破坏铝表面的氧化膜 (1分)
(3)2Al 3CuSO4== Al2(SO4)3 3Cu (1分)
(4)氯离子对铝和CuCl2溶液的反应有促进作用;硫酸根离子对铝和CuSO4溶液的反应有抑制作用。(1分)
| |