|
说明:答题时间60分钟。本卷四个大题,满分80分。
可能用到的相对原子质量(原子量):
H—1 C—12 O—16 Cl—35.5 K—39 Fe—56 Zn—65
一.选择题(下列各题只有一个选项符合题意,将正确答案的序号填入题后括号内。每小题2分,共30分。)
1.下列变化中属于物理变化的是( )
(A)食物腐烂 (B)钢铁生锈 (C)水结成冰 (D)火药爆炸
2.能保持氢气化学性质的微粒是( )
(A)氢元素 (B)氢离子 (C)氢原子 (D)氢分子
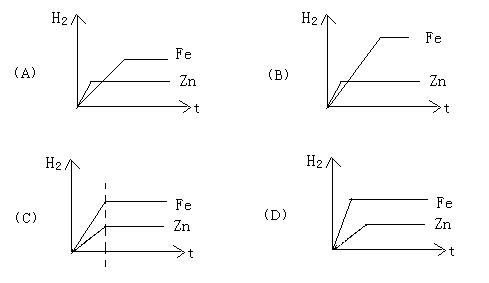
3.燃烧、缓慢氧化和自燃的相同点是( )
(A)都需点燃 (B)反应都很剧烈 (C)都有火焰 (D)都属于氧化反应
4.实验室制备氢气常用( )
(A)锌跟浓硫酸反应 (B)铜跟稀盐酸反应 (C)锌跟稀硫酸反应 (D)镁跟浓盐酸反应
5.化学反应前后肯定没有发生变化的是( )
(A)原子的种类和数目 (B)分子的种类 (C)分子的数目 (D)物质的种类
6.下列说法正确的是( )
(A)相对原子质量就是原子的实际质量。
(B)组成中含氧的化合物就是氧化物。
(C)凡有单质和化合物生成的反应就是转换反应
(D)原子是化学变化中的最小微粒。
7.下列物质中属于化合物的是( )
(A)氮气 (B)氢气 (C)碱或碳酸铜 (D)天然水
8.将61.25克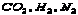 和1.5克 和1.5克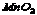 混合后加热,充分反应后试管里剩余固体物质的质量是( ) 混合后加热,充分反应后试管里剩余固体物质的质量是( )
(A)38.75克 (B)37.25克 (C)14.75克 (D)46.75克
9.等质量的锌和铁分别与足量的稀硫酸反应,能正确表示生成氢气的质量(纵坐标)与时间(横坐标)的关系的图象是( )
10.下列有关溶液的叙述中,正确的是( )
(A)均一、稳定的液体都是溶液
(B)饱和溶液中溶质的质量分数一定大于不饱和溶液中溶质的质量分数
(C)固体的溶解度随溶剂的质量改变而改变
(D)析出晶体后的溶液一定是该温度下的饱和溶液
11.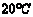 时 时 的溶解度是36克,问100克饱和 的溶解度是36克,问100克饱和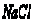 饱和溶液中加入5克食盐晶体,溶液在温度不变的条件下,其溶质的质量分数为( ) 饱和溶液中加入5克食盐晶体,溶液在温度不变的条件下,其溶质的质量分数为( )
(A)25% (B)26.5% (C)29.5% (D)30%
12.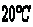 时,50克水中最多溶解2.5克M物质; 时,50克水中最多溶解2.5克M物质;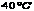 时,80克水中最多溶解4.0克N物质,则两种物质的溶解度相比较( ) 时,80克水中最多溶解4.0克N物质,则两种物质的溶解度相比较( )
(A)M>N (B)M<N (C)M=N (D)无法比较
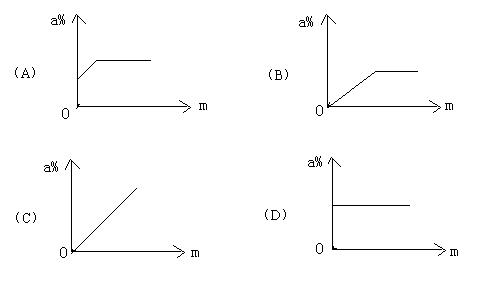
13.某温度下,向一定质量水中不断加入食盐晶体,同时不断搅拌,表示加入食盐的质量(m)与所得溶液中溶质的质量分数的图象中,正确的是( )
14.用氯化钠的固体配制溶质的质量分数一定的氯化钠溶液必须使用的一组仪器是:①天平 ②烧杯 ③玻璃棒 ④蒸发皿 ⑤量筒⑥水槽 ⑦集气瓶 ⑧铁架台 ⑨漏斗 ( )
(A)①②③④ (B)①②③⑤ (C)①②⑥⑦ (D)①②⑧⑨
15.下面是甲、乙、丙、丁四位同学在实验中的有关操作,其中正确的是( )
(A)甲在称量时,把氢氧化钠固体直接放在天平左盘的纸片上。
(B)乙在药品需取少量情况下,取溶液8-10毫升。
(C)丙在用向上排空气法收集氧气时,将导管插入集气瓶并靠近瓶底。
(D)丁在量取液体时,将多余的液体倒回原试剂瓶。
二.填空题(每空1分,共30分)
16.写出下列物质的名称或化学式:
(1)氢氧化钠__________________ (2)硫化锌__________________
(3)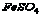 __________________ (4) __________________ (4)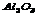 __________________ __________________
17.用化学符号表示:
(1)+3价的铝元素__________________ (2)镁离子__________________
(3)两个钠原子__________________ (4)4个二氧化硫分子__________________
18.纯净的氢气在空气中能安静地燃烧,产生________色火焰;如果氢气中混有空气,点燃时可能会________,因此点燃氢气前,一定要________。
19.在化肥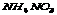 中氮元素化合价 中氮元素化合价 为________________ 氮元素的质量分数为________。 为________________ 氮元素的质量分数为________。
20.A、B、C三种物质的溶解度如图所示,据图回答
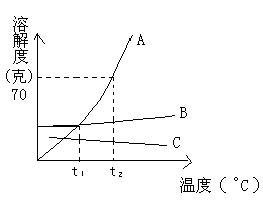
(1)在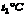 时,三种物质的溶解度大小关系为A B C(填“>”“=”“<”) 时,三种物质的溶解度大小关系为A B C(填“>”“=”“<”)
(2)在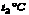 时,85克A物质的饱和溶液中,含A物质的质量为________ 时,85克A物质的饱和溶液中,含A物质的质量为________
(3)要将B物质从它的饱和溶夜中析出,应采用的方法是________(填过滤、蒸发或结晶)
21.写出下列反应的化学方程式并在括号内注明基本反应类型
(1)用废干电池中的锌在实验中制氧气________________ [ ]
(2)红磷在空气中燃烧________________ [ ]
(3)加热胆矾晶体________________ [ ]
22.配平下列方程式:
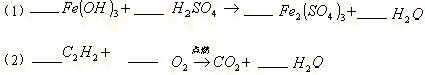
23.取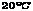 时某物质A的饱和溶液100克,将其加热蒸干后,得到26.5克A晶体(不含结晶水)则 时某物质A的饱和溶液100克,将其加热蒸干后,得到26.5克A晶体(不含结晶水)则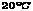 时该物质的溶解度为_______ 时该物质的溶解度为_______
24.在天平的两个托盘上各放一个等质量的烧杯,分别加入等质量的同种盐酸,再分别加入等质量的铁和锌,反应充分后,发现烧杯内均有金属剩余,此时天平指针_____________。(不动、向右偏转、向左偏转)
25.现有甲、乙、丙、丁四种物质和A、B两种无色、无味气体,它们相互转化关系如下:
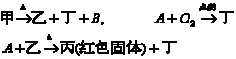
写出下列物质的化学式:乙______ 丁________ A________ B_________
三.实验题(每空1分,共12分)
26.根据下列装置图回答问题:
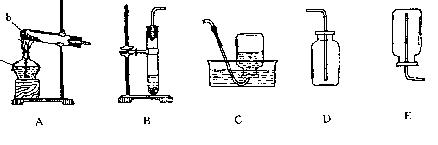
(1)写出图中标有字母的仪器名称:a_____________ b_____________
(2)装置B可用于实验室制备_____________气体
(3)实验室制备并收集氧气,应选用装置_____________和_____________装置_____________或_____________连接(填装置序号),制取氧气的化学方程式为__________________________,如果选用的收集装置需要检验氧气是否集满,应将带火星的木条放在_____________。
27.实验室用氢气还原氧化铜,有下列主要操作:
a.加热 b.停止加热 c.通氢气 d.停止通氢气
正确操作顺序是_____________,实验过程观察到的主要现象是:(1)_____________,(2)_____________
28.某气体可能含有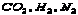 中的一种或几种,依次进行以下实验: 中的一种或几种,依次进行以下实验:
(1)将气体通入澄清的石灰水中,无沉淀
(2)将气体通入灼热的氧化铜,黑色粉末变红色,且有水珠出现
则原混合气体中一定含有_____________,一定没有_____________。
四.计算题(29题3分,30题5分,共8分。计算最后结果保留一位小数。)
29.取13克锌与足量稀硫酸完全反应,求可制得氢气多少克?
30.取29克由干燥的氯酸钾和二氧化猛组成的固体混合物,加热,待完全反应后将残留固体放入25克水中,温度控制在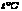 时充分搅拌,过滤,干燥,得11.9克固体,再将所得固体放入一定量水中,发现有部分固体溶解。试求: 时充分搅拌,过滤,干燥,得11.9克固体,再将所得固体放入一定量水中,发现有部分固体溶解。试求:
(1)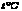 时,25克水中溶解了多少克氯化钾?(已知t℃时氯化钾溶解度为30克) 时,25克水中溶解了多少克氯化钾?(已知t℃时氯化钾溶解度为30克)
(2)原混合物中氯酸钾的质量分数是多少?
参考答案
一.选择题
1.C 2.D 3.D 4.C 5.A 6.D 7.C 8.A 9.A
10.D 11.B 12.D 13.B 14.B 15.C
二.填空题
16.(1)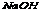 (2) (2)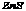 (3)硫酸亚铁 (4)氧化铝 (3)硫酸亚铁 (4)氧化铝
17.(1)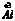 (2) (2)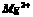 (3) (3) (4) (4)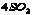
18.淡蓝;爆炸;验纯
19.-3,+5,35%
20.(1)A=B>C;(2)35克;(3)蒸发
21.(1)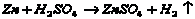 [置换反应] [置换反应]
(2)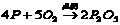 [化合反应] [化合反应]
(3)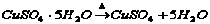 [分解反应] [分解反应]
22.(1)2,3,1,6 (2)2,5,4,2
23.36.1克
24.不动
25.乙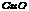 ;丁 ;丁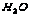 ;A ;A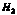 ;B ;B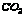
三.实验题:
26.(1)酒精灯,试管
(2)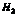
(3)A,C或D,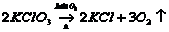
(4)靠近集气瓶口部
27.c,a,b,d;(1)黑色粉末变成红色固体 (2)试管口有无色液滴
28.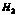 , ,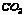
四.计算题
29.0.4克
30.解:设25克水可溶解氯化钾的质量为x
(1)
(2)由质量守恒定律,生成氧气的质量为:
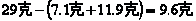
设原混合物中氯酸钾的质量为y
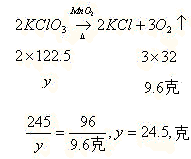
原混合物中氯酸钾的质量分数为:

答:(略)
|