|
一.有三瓶溶液,一瓶为纯水,一瓶含Cl-,一瓶含金属离子,怎样鉴别它们?
二.基准物质有何特点?它应符合哪些要求?
三.找出下列文章中的错误:
现要测定试样中碳酸钠的质量分数,用分析天平称取试样0.75025克放在已于100℃烘干的干净小烧杯中,加水溶解,再转移到已于100℃烘干的250毫升干净的容量瓶中,定容摇匀;用试液荡洗250毫升锥形瓶,再用烘干的25.00毫升移液管移取25.00毫升试液于锥形瓶中,加50毫升水和2滴甲基红指示剂,用0.010摩/升盐酸滴定,用去21.46毫升,所以碳酸钠的质量分数为:Na2CO3%=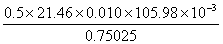  100% 100%
四.下列说法是否正确,为什么?
(1) 沉淀颗粒越小,溶解度越大.
(2) 同类型反应的K值越大,反应越完全,速度越大
(3) 在进行滴定分析时,滴定管、移液管、容量瓶、锥形瓶均要用标准溶液洗涤.
五.浓度为0.002000摩/升的KMnO4对Fe的滴定度是多少?
六.用酚酞和甲基橙作指示剂,用HCl滴定Na2CO3,发现第一计量点时V1=10.96ml ,第二计量点时V2=21.88ml ,为什么V2≠2 V1?
七.下列物质各应装在什么滴定管内?
I2 EDTA AgNO3 NaCl Na2S2O3 K2Cr2O7
八.实验室保存下列基准物的方法正确吗?
(1)在500℃时把碳酸钠烘1小时,再保存在干燥器中
(2)把硼砂晶体放干燥器中保存
(3)草酸晶体放干燥器中保存.
九.测定样品中HCHO的含量:取0.3g样品溶于水,加入40ml 0.100mol/LNaOH和少量的NH4Cl,加水到100ml ,放置一会儿后用某指示剂滴到变色(PH=6.8),再用0.100mol/L HCl返滴,用去处15.40ml .求:
(1)HCHO的质量分数
(2)若样品中含0.2%HCOOH,求HCHO的质量分数
(3)为何用此种指示剂?
(4)若HCHO含量为以上答案的二倍,问测定方法有何改变?
十.有一含Na2S的样品,放置在空气中被氧化成Na2S2O3,将样品溶于水,加入20.00 ml 0.1000mol/L的碘水,反应后用0.2000mol/L Na2S2O3滴定剩余的I2 ,用去10.79 ml ,求:
(1)有多少Na2S被氧化?
(2)样品组成是什么?
十一.少量的碘化物可利用化学放大反应进行测定,其步骤如下:在中性或弱酸性介质中,先用Br2将试样中I-定量氧化成碘酸盐,煮沸除去过量的Br2 ,然后加入过量的KI,用CCl4萃取生成的I2 ,分去水相后,用肼的水溶液将I2反萃取至水相(H2N-NH2 + 2I2 = 4I- + N2 + 4H+),再用过量的Br2氧化,除去剩余Br2后加入过量KI,酸化,淀粉作指示剂,用Na2S2O3标准溶液滴定,求得I-的含量.
(1)写出上述过程的所有配平化学方程式.
(2)根据有关反应的计量关系,说明经上述步骤后,试样中1摩I-可消耗几摩尔Na2S2O3?相当于放大到多少倍?
(3)若在测定时,准确移取含KI的试液25.00ml,终点时耗用0.100mol/L Na2S2O3 20.06ml,计算试液中KI的含量(g/L),Mr(KI)=166
(4)仍取相同体积的上述试液,改用0.100mol/L AgNO3作滴定剂,曙红作指示剂,试用最简便的方法计算终点时所需滴定剂的体积(ml)
(5)在(3)和(4)所述的二种方法中,因滴定管读数的不准确性而造成体积测量的相对误差各为多少?并以此例,简述化学放大在定量分析中的意义.
十二.在Zn2+、Cd2+浓度均为0.0200mol/L溶液中用I-掩蔽Cd2+,用EDTA滴定Zn2+,终点时[I-]=0.5mol/L ,PH=5.0 ,求终点误差是多少?
十三.置换滴定法是提高络合滴定选择性的途径之一,利用它可以改善指示剂指示终点的敏锐性.试举一例说明.
十四.为什么EDTA滴定金属离子时,溶液中通常要加入缓冲溶液?
十五.为了提高滴定准确度,常在EDTA滴定Ca2+,用PAN作指示剂的实验中加入少量CaY,试分析为什么滴定结果不会改变?
十六.简要写出下列物质的滴定方案:
(1) Fe3+、Ca2+混合液,测Ca2+;
(2) CaY溶液(有可能有Ca2+或Y)中Ca2+、Y的含量;
(3) Fe3+、Al3+、Ca2+、Mg2+混合液中各自含量的测定;
(4) Ca2+、Al3+混合液中Al3+含量的测定;
(5) Zn2+、Cd2+混合液中Zn2+的测定;
(6) Fe3+、Bi3+混合液中Bi3+的测定;
(7) Pb、Zn、Cu合金中Pb、Zn含量的测定.
十七.为什么Al3+不能用EDTA直接滴定?常用什么方法滴定?
十八.写出下列溶液中的质子方程式:
(1) 0.1mol/L Na2HPO4的溶液;
(2) 0.1mol/L H2N-CH2-CH2-NH2的溶液;
(3) 0.1mol/L HCl和0.01mol/L HAc溶液;
(4) a mol/L NaOH和b mol/L Na2C2O4混合溶液;
(5) HAc和NaAc混合溶液;
(6) HAc和NaF混合溶液.
十九.求下列溶液中[H+]浓度
(1) 0.10mol/L (NH4)2HPO4;
(2) 0.10mol/L NaNH4HPO4;
(3) 0.050mol/L H3BO3和0.20mol/L NaAc混合溶液.
二十.计算0.10mol/L NaCl和0.10mol/L HAc混合溶液的精确PH值.(要考虑离子强度)
二十一.有一种酸HA ,其离解常数Ka=1.0×10-6,浓度为0.2000mol/L,用等浓度的NaOH滴定.求:
(1)等当点时PH值是多少?
(2)滴定中滴定突跃是多少?
(3)若选用酚酞作指示剂,滴定误差是多少?
二十二.有两种酸HB1(K=1.0×10-3),HB2(K=1.0×10-5)的溶液,其浓度均为0.05000mol/L,用NaOH滴定,求:
(1)计量点时PH值为多少?
(2)如果用某指示剂指示终点,滴到PH=8.0才停止,求终点误差.
二十三.有两种酸HA、HB,其浓度分别为0.20mol/L,0.40mol/L,离解常数分别为10-2.0和10-7.0,现要分别测定出它们的含量,用0.20mol/L NaOH进行分别滴定,问该选什么作指示剂,为什么?
二十四.怎样测定下列混合液中各物质含量?写出实验方案.
(1)NaHPO4 + H3PO4 ;
(2)HCl + H3PO3 ;
(3)KH2PO4 + Na2HPO4
二十五.用0.100mol/L HCl滴定0.0500mol/L CH3NH2和0.0500mol/L NH3的混合溶液,问:
(1)化学计量点时PH值是多少?
(2)若终点时PH值比计量点时PH值低声下气0.5个PH单位,问终点误差是多少?
二十六.在测定HCl和Fe3+混合溶液中HCl的含量时,为什么不能直接用NaOH滴定HCl?此时能加下列物质的溶液作为Fe3+的掩蔽剂吗?
(1)CaY (2)EDTA (3)柠檬酸 (4)乙二醇胺
二十七.当用EDTA滴定Cu2+和Mg2+混合液时(浓度相同),其滴定曲线如图A所示;而加入氨水,使[NH3]=0.2mol/L时,其滴定曲线如图B所示.为什么?
二十八.在分析实验中,常常用到硫酸铈法,它的优点是什么?用它作滴定剂对溶液有何要求?一般用什么作指示剂?
二十九.某试样中含有PbO和PbO2 ,欲分别测定其含量.称1.234g试样,加入20.00ml 0.2500mol/L的H2C2O4溶液,待沉淀完全后,过滤,滤液中加入H2SO4,用0.04000KMnO4滴定,用去10.00ml,将沉淀溶于H2SO4,用上述KMnO4滴定,用去30.00ml,求试样中PbO和PbO2的含量.
三十.用间接碘量法测定Cu时,Fe3+和AsO43-均能氧化I-而干扰Cu的测定,加入0.005mol/L NH4HF2即能消除Fe3+及AsO43-的干扰,试通过计算说明之.
已知:EoAs(V)/As(Ⅲ)= 0.559V;EoFe(Ⅲ)/Fe(Ⅱ)= 0.771V ; EoI2/I-= 0.534V;
HF: Ka= 7.4×10-4 ; FeF63-的lgβ1—lgβ2分别为5.2;9.2;11.9;
三十一.有0.100mol/L H4Y 10.00ml ,用等浓度的NaOH进行滴定,求:
(1)此滴定反应的滴定曲线;
(2)求此溶液中各种存在形式的分布系数与溶液PH值的关系;
(3)当加入等量的Cu2+,用NaOH滴定,滴定曲线如何?
三十二.在以氨性缓冲溶液(NH3-NH4Cl)控制酸度(PH=9.00)的Zn2+溶液中,不断通入H2S到饱和(饱和H2S浓度约为0.10mol/L).如果平衡后[NH3]= 0.10mol/L,酸度基本不变.计算:
(1)pZn sp和pZn ep ;
(2)Zn2+/Zn电对的条件电位.已知:ZnS pKsp=21.7; Zn2+—NH3络合物lgβ1—lgβ4依次为2.27;4.61;7.01;9.06; H2S: pKa1=6.88,pKa2=14.15; EoZn2+/Zn=-0.763V
三十三.计算在PH=8.00,NH4Cl总浓度为0.20mol/L的溶液中MgNH4PO4的溶解度.已知MgNH4PO4:pKsp=12.7;NH4+:pKa=9.26;H3PO4:pKa1=2.12,pKa2=7.20,pKa3=12.36
三十三.弱酸HA在有机相和水相之间的分配系数KD=20 ,如果在PH=5.00时用等体积的有机溶剂萃取一次,萃取效率为91%,求HA的离解常数Ka .
三十四.用EDTA滴定金属离子的基本原理是形成络离子,可用H4Y表示EDTA.Y4-的浓度与溶液的PH值密切相关,因而得知溶液的PH值对滴定曲线的确定十分重要,这种相关性可以用α4值来表示.人们定义α4=[Y4-]/Ct ,其中Ct=EDTA的总浓度,即Ct=[Y4-]+[HY3-]+[H2Y2-]+[H3Y-]+[H4Y]
(1)试推出下面的α4与H+浓度的关系式.
(2)计算PH=9时的α4 ,已知pK1—pK4的值分别为2.0 ,2.67 ,6.16 ,10.26
可以在不同的PH值下用0.01mol/L EDTA滴定点50ml 0.01mol/L Ca2+ .计算:
(3)计算PH=9时添加25ml 、50ml(化学计量点)、75ml EDTA后,未与EDTA结合的Ca2+离子的浓度.
(4)以pCa代表钙量为纵坐标,EDTA的添加量为横坐标画出PH=7、9、11的滴定曲线.
(5)试问:当改用结合力较弱的离子,如Mg2+时,滴定曲线将呈现什么变化?
已知:KCaY=5×1010 KMgY=5×108
|