| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
2、氢氧化钠是 色的 体, 于水。它露置在空气中,表面会发生潮解,这是因为它 的缘故。同时它还能与空气中的 发生反应,其化学方程式为 ,从而使氢氧化钠变质;因此,氢氧化钠固体必须 保存;而它的水溶液也必须 保存。 3、以H、O、K、S四种元素中,选择适当的元素组成下列各类物质。(要求写化学式且每类物可能不只一种) (1)碱 。 (2)含氧酸 。 (3)碱性氧化物 。 (4)酸性氧化物 。 (5)酸式盐 。 (6)正盐 。 4、浓硫酸稀释时,一定要把 沿器壁 倒入 里,并且用 不断搅拌;使产生的 迅速扩散。 5、用赤铁矿石(主要成分是Fe2O3)冶炼铁的主要反应的化学方程式为 。在反应中,还原剂是 ,被还原的物质是 。 6、现有铁、石灰水、硝酸钡溶液,碳酸钠溶液、稀盐酸,这五种物质分别是下图A、B、C、D、E中的一种物质:
它们之间的连线表明相邻的两种物质之间能发生化学反应。由此推断图中A、B、C、D、E表示的物质可能是(请写化学式): A ,B ,C , D ,E 。 发生有关反应的化学方程式为: (1) , (2) , (3) , (4) , (5) , (6) , (7) 。 三、简答题: 1、现有HCl、NaOH、FeCl3、CuSO4、AgCl五种物质的溶液,从其中选用适当的物质实现下列要求的反应,写出有关反应的化学方程式即可: (1)有红褐色沉淀生成的反应: ; (2)有水生成的反应: ; (3)有蓝色沉淀生成的反应: ; (4)有白色沉淀生成且不溶于稀硝酸的反应: ① ; ② 。 2、用最简便的方法检验生石灰水中含有未完全分解完的碳酸钙: (1)所加试剂是 ; (2)观察到的现象是 ; (3)有关反应的化学方程式 。 3、下列各题中括号内的物质为少量杂质,请写出用一种试剂除去杂质的化学方程式: (1)NaOH(Na2CO3): ; (2)NaCl(Na2CO3): ; (3)NaCl(Na2SO4): ; (4)NaCl(MgCl2): 。 4、写出实现下列转化的化学方程式(各举一例即可): (1)有气体生成的化学方程式: ; (2)有水生成的化学方程式: ; (3)有沉淀生成的化学方程式: 。 四、实验题: 1、有一包固体粉末,可能由Na2CO3、BaCl2、CuSO4、Na2SO4、KNO3中的一种或几种组成。做如下实验: (1)将此固体粉末加水、搅拌、过滤,得无色溶液及白色沉沉; (2)将白色沉淀加适量稀HCl,沉淀部分溶解,同时产生无色气体,该气体能使澄清石灰水变浑浊; (3)将未溶解的白色沉淀加入稀硝酸,白色沉淀不溶解。 推断:原固体粉末中一定含有 ,可能含有 ,一定不含有 。 写出有关反应的化学方程式: ① ; ② ; ③ ; ④ 。 2、由一种碱和一种正盐组成的固体混合物,按下列步骤进行实验。
由上述实验步骤、实验现象及生成物推断,该混合物可能由 组成。 五、计算题: 1、将二氧化碳通入氢氧化钠溶液中,完全反应后,溶液增重17.6克。求参加反应的氢氧化钠的质量是多少克? 2、用20吨含Na2CO3 60%的天然碱与消石灰反应来制取火碱,在生产过程中损失Na2CO3 1%,试计算能生产98%的火碱多少吨? 3、把铜和氧化铜的混合物2克,通入足量的氢气,加热充分反应,得到1.84克铜。那么,原混合物中氧化铜的质量分数是多少? 4、10克氯化钾溶液与10克硝酸银溶液恰好完全反应,生成沉淀1.435克,求: (1)硝酸银溶液中,溶质的质量分数是多少? (2)反应后溶液中溶质的质量分数是多少? (3)若20℃时,硝酸钾的溶解度为31.6克,要使反应后的溶液变成20℃时的饱和溶液,需要蒸发掉水多少克?
【参考答案】: 一、选择题:
| 题号
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
| 答案
| D
| C
| B
| C
| C
| D
| A
| B
| C
| 题号
| 10
| 11
| 12
| 13
| 14
| 15
| 16
| 17
| 18
| 答案
| D
| C
| A
| C
| D
| B
| A
| C
| B
| 题号
| 19
| 20
| 21
| 22
| 23
| 24
| 25
| 26
| 27
| 答案
| C
| D
| A
| B
| C
| A
| B
| D
| C
| 题号
| 28
| 29
| 30
| 31
| 32
| 33
| 34
| 35
| 36
| 答案
| C
| B
| A
| D
| C
| B
| D
| C
| C
| 题号
| 37
| 38
| 39
| 40
| 41
| 42
| 43
| 44
| 45
| 答案
| A
| A
| B
| C
| D
| B
| A
| C
| D |
二、填空题:
1、填表:
俗称
名称
化学式
类别
氢氧化钠
NaOH
碱
盐酸
HCl
碱
熟石灰
氢氧化钙
碱
五水硫酸铜
CuSO4·5H2O
盐(或结晶水合物)
生石灰
CaO
碱性氧化物
2、 白;固;易溶;吸收空气中的水蒸气
二氧化碳
2NaOH CO2 ![]() Na2CO3 H2O
Na2CO3 H2O
密封;密封
3、 (1)NaOH
(2)H2SO3 H2SO4
(3)Na2O
(4)SO2 SO3
(5)NaHSO3 NaHSO4 NaHS
(6)Na2SO3 Na2SO4 Na2S
4、浓硫酸;慢慢;水;玻璃棒;热量
5、 ![]()
CO;Fe2O3
6、A:Fe B:HCl C:Ca(OH)2 D:Na2CO3 E:Ba(NO3)2
![]()
![]()

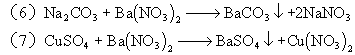
三、简答题:
1、 (1)3NaOH FeCl3 ![]() Fe(OH)3¯ 3NaCl
Fe(OH)3¯ 3NaCl
(2)NaOH HCl ![]() NaCl H2O
NaCl H2O
(3)2NaOH CuSO4 ![]() Cu(OH)2¯ Na2SO4
Cu(OH)2¯ Na2SO4
(4)①HCl AgNO3 ![]() AgCl¯ HNO3
AgCl¯ HNO3
②FeCl3 3AgNO3 ![]() 3AgCl¯ Fe(NO3)3
3AgCl¯ Fe(NO3)3
2、 (1)稀盐酸
(2)有无色气体生成
(3)2HCl CaCO3 ![]() CaCl2 H2O CO2
CaCl2 H2O CO2
3、 (1)Na2CO3 Ca(OH)2 ![]() CaCO3¯ 2NaOH
CaCO3¯ 2NaOH
(2)Na2CO3 2HCl ![]() 2NaCl H2O CO2
2NaCl H2O CO2
(3)Na2SO4 BaCl2 ![]() BaSO4¯ 2NaCl
BaSO4¯ 2NaCl
(4)MgCl2 2NaOH ![]() Mg(OH)2¯ 2NaCl
Mg(OH)2¯ 2NaCl
4、 (1)2KClO3 ![]() 2KCl 3O2
2KCl 3O2
(2)NaOH HCl ![]() NaCl H2O
NaCl H2O
(3)CuSO4 BaCl2 ![]() BaSO4¯ CuCl2
BaSO4¯ CuCl2
四、实验题:
1、 一定含有:Na2SO4、Na2CO3、BaCl2
可能含有:KNO3
一定不含有:CuSO4
①Na2SO4 BaCl2 ![]() BaSO4¯ 2NaCl
BaSO4¯ 2NaCl
②Na2CO3 BaCl2 ![]() BaCO3¯ 2NaCl
BaCO3¯ 2NaCl
③BaCO3 2HCl ![]() BaCl2 H2O CO2
BaCl2 H2O CO2
④Ca(OH)2 CO2 ![]() CaCO3¯ H2O
CaCO3¯ H2O
2、NaOH和CaCO3或Ca(OH)2和Na2CO3(组成)
五、计算题:
1、 分析:根据质量守恒定律,增加的质量必为参加反应的二氧化碳的质量。
解:设参加反应的氢氧化钠的质量为x
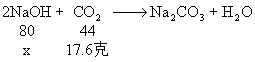
![]()
![]()
答:略
2、 分析:
(1)20吨天然碱中含纯Na2CO3的质量可求:
20吨×60% = 12吨
(2)由于实际生产中损失了1%的Na2CO3,实际用于生产即参加反应的Na2CO3的质量为:
12吨-12吨×1% = 11.88吨
因此可求生产出来的纯NaOH的质量。
解:设可生产纯NaOH的质量为x
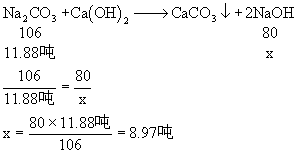
∴可得98%的火碱:
8.97吨÷98%=9.15吨
答:略
3、分析:只要明确1.84 克铜是原混合物中的铜与被还原出来的铜的总合,这道题就迎刃而解了。
解:设原混合物中铜的质量为x

解得:x = 1.2克
∴原混合物中含CuO:
2克-1.2克 = 0.8克
混合物中氧化铜的质量分数为
![]()
答:略
4、解:设参加反应的纯AgNO3的质量为x,生成硝酸钾的质量为y。

(1)10克硝酸银溶液中,溶质的质量分数:
![]()
(2)反应后,溶液的总质量:
(10+10-1.435)克 = 18.565克
反应后,溶液中溶质的质量分数:
![]()
(3)根据溶解度的概念:
设z克水溶解1.01克KNO3达到饱和:
100∶31.6 = z∶1.01
![]() (克)
(克)
应蒸发水的质量为:
(18.565-1.01-3.2)克
=14.36克
答:略
| |