| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
说明:全卷满分100分,考试时间:80分钟 可能用到的相对原子质量: H:1 O:16 S:32 K:39 Na:23 Al:27 一、选择(每小题只有一个正确答案,每题2分,共28分) 1.下列变化中的一种与其它有本质区别的是( ) A.加热双氧水制氧气 B.二氧化碳气体制成干冰 C.酒精燃烧 D.水在通电的条件下产生气体 2.目前,世界上有20多亿人口面临淡水危机,有关部门呼吁市民要节约用水,下列做法中与节约用水无关的是( ) A.淘米水用来浇花 B.开发利用地下水 C.使用节水龙头 D.用喷灌、滴灌方法给农作物浇水
A. B. C. D. 4.X、Y、Z三种金属中,只有Z能与稀硫酸反应,当把Y放入X的盐溶液时,Y表面有X析出。则X、Y、Z三种金属的活动性顺序为( ) A.X>Y>Z B.Y>X>Z C.Z>Y>X D.Y>Z>X
A. 该物质不是有机物 B. 该物质的化学式是C2H6O C. 该物质不是可燃物 D. 大量饮用该物质对人体有益 6.下列实验操作叙述正确的是( ) A.把块状固体投入竖立的试管中 B.给试管加热时,试管口不要对着人 C.未用完的药品放回原试剂瓶中 D.实验产生的废液直接倒入下水道 7.牙膏里添加的单氟磷酸钠(Na2PO3F)可有效防止龋齿。关于单氟磷酸钠的说法正确的是( ) A. 它是由钠、磷、氧、氟四个原子组成的 B. 它是由钠、磷、氧、氟四种元素组成的 C. 单氟磷酸钠中钠、磷、氧、氟元素的质量比为2:1:3:1 D. 它是由2个钠元素、1个磷元素、3个氧元素、1个氟元素组成的 8.下列操作或现象与分子对应的特性不一致的选项是( )
| 选项
| 操作或现象
| 分子的特性
| A
| 给篮球充气
| 分子间有间隔
| B
| 在花园中可闻到花的香味
| 分子是运动的
| C
| 100mL酒精和100mL水混合在一起,体积小于200mL
| 分子是有质量的
| D
| 加热氧化汞可得到金属汞和氧气
| 分子是可以再分的 |
9.打雷放电时,空气中极少量氧气会转化成臭氧(3O2=2O3),下列有关说法中正确的是( )
A.该变化是物理变化 B.O2与O3都是单质
C.O2与O3是不同的物质 D.O2与O3的性质完全相同
|
D |
|
C |
|
B |
|
A |
|
时间/t |
|
0 |
|
7 |
|
PH |
|
时间/t |
|
0 |
|
7 |
|
PH |
|
7 |
|
时间/t |
|
0 |
|
PH |
|
时间/t |
|
7 |
|
PH |
|
0 |
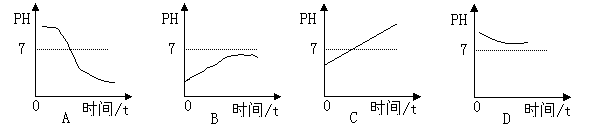 10.某种消化药片的有效成分氢氧化镁,能减缓因胃酸过多引起的疼痛。在氢氧化镁与胃酸作用的过程中,胃液PH变化的情况是( )
10.某种消化药片的有效成分氢氧化镁,能减缓因胃酸过多引起的疼痛。在氢氧化镁与胃酸作用的过程中,胃液PH变化的情况是( )
11.盐是人体正常生理活动必不可少的物质。这里的盐是指( )
A. NaHCO3 B. NaCl C. CuSO4 D. CaCO3
 12.硅酸盐矿泉具有软化血管的作用,对心脏病、高血压等疾病患者有良好的医疗保健作用。硅酸钠的化学式为Na2SiO3,其中硅元素的化合价为( )
12.硅酸盐矿泉具有软化血管的作用,对心脏病、高血压等疾病患者有良好的医疗保健作用。硅酸钠的化学式为Na2SiO3,其中硅元素的化合价为( )
A. 1 B. 2 C. 3 D. 4
13.右图装置里所发生的化学反应,其反应类型属于( )
A. 化合反应
B. 分解反应
C. 置换反应
D. ![]()
![]()
![]()
![]() 分解反应
分解反应
14.甲醛(化学式为:CH2O)是一种无色、有刺激性气味的气体,易溶于水,有毒。为使服装达到防皱、改善手感等效果,在加工中需添加甲醛。但衣物中残留的甲醛超标会损害人体健康。以下说法或做法错误的是( )
A. 甲醛属于有机物
B. 甲醛属于氧化物
C. 买回服装后先用水洗,有利于除去残留的甲醛
D. 新买的服装若有刺激性气味,有可能是甲醛会超标
二、填空(本题有6小题共20分)
15.(4分)常用的石蕊试液呈色 色,遇稀盐酸变 色,遇氢氧化钾溶液变 色,因而它可用于检验溶液的 性。
16.(4分)用符号表示下列含义或写出符号的含义:
①2个氢原子 ②2个氯分子 ③氢硫酸
④Fe3 。
|
引爆剂 |
![]() 17.(2分)闻名的发明家诺贝尔经过长期的研究与试验,终于发明了安全炸药—三硝酸甘油酯,三硝酸甘油酯的化学式为C3H5N3O9,这种炸药发生爆炸的反应方程式为:
17.(2分)闻名的发明家诺贝尔经过长期的研究与试验,终于发明了安全炸药—三硝酸甘油酯,三硝酸甘油酯的化学式为C3H5N3O9,这种炸药发生爆炸的反应方程式为:
4C3H5N3O9 12CO2↑ 10H2O↑ 6X↑ O2↑
①X的化学式是: 。②推断X的化学式的依据是 。
18.(4分)汽油是石油炼制产品之一,是汽车的主要燃料。请回答:
①汽油充分燃烧的产物是二氧化碳和水,由此可推断汽油的组成元素一定含有 元素。
②以汽油为燃料的汽车尾气中含有一氧化碳、氮的氧化物等大气污染物。目前,减少汽车尾气污染的措施之一,是在汽油中加入适量的乙醇。乙醇完全燃烧的化学方程式为: 。(2分)
③下列能替代汽油的燃料中,燃烧产物最清洁的是 (填编号)
A.天然气 B.乙醇 C.氢气
19.(3分)甲和乙两种物质溶解度曲线如图所示:
|
甲 |
|
乙 |
|
温度(0C) |
|
0 |
|
60 |
|
60 |
|
40 |
|
40 |
|
20 |
|
20 |
|
溶解度 /g |
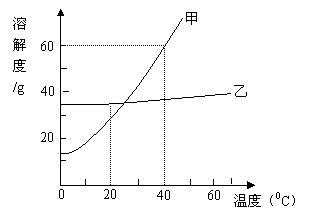 ①200C时,甲的溶解度比乙的溶解度
①200C时,甲的溶解度比乙的溶解度
(填“大”或“小”)
②400C时,在100g水中加入80g甲固
体,充分搅拌所得溶液的质量
是 g;
③500C时,某溶液所溶解的甲和乙物质
都已饱和。把该溶液冷却到室温,有晶
体析出,经验发现析出的晶体主要是甲,其原因是 (填编号)
A.500C时,甲的溶解度更大 B.500C时,乙的溶解度更大
C.甲的溶解度受温度变化的影响比乙大
20.(5分)今年5月,云南省某地一个内装白磷的储罐因泄漏而迅速自发引起大火,现场白烟弥漫。消防人马上采用冷却罐体,再用沙土围堰填埋的方式灭火,火势很快得到控制。已知白磷和红磷都是磷元素组成的单质,它们化学性质相似。请回答:
①白磷与红磷比较,在空气中更轻易着火燃烧的是 ;
②白磷燃烧的化学方程式为: ;
③消防人员采用的灭火方法原理是: 。
|
氢氧化钠溶液 |
|
步骤② |
|
盐酸 |
|
酚酞 |
|
步骤① |
 三、(本题有2小题,共18分)
三、(本题有2小题,共18分)
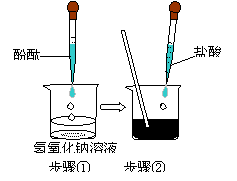
21.(8分)某爱好小组用右图所示装置做酸碱中
和反应实验,试回答:
①用胶头滴管吸取盐酸逐滴加入烧杯中,当溶液
刚好由 色变成 色时,停止加入
盐酸,该反应的化学方程式为
。
②实验①中,某同学不小心又多加了几滴盐酸,这时溶液的PH 7(填“>”“<”“=”)
③若要除去实验②中过量的盐酸可选用的试剂是 (填化学式)
④中和反应在实际中具有广泛的应用,请举出一个实例:
。
22.(10分)某课外活动小组用一种常见的黑色固体合金A做了如下实验:
|
加稀硝酸 |
|
加硝酸钡溶液 |
|
②加入B |
|
通入澄清石灰水 |
|
干燥,通入X 高温 |
|
X |
|
气体E |
|
黑 色固体合金A |
|
加入B 过滤 |
|
滤液D |
|
固体C |
|
不溶解 |
|
变浑浊 |
|
①红色粉末 高温 |
|
F |
|
白色沉淀 |
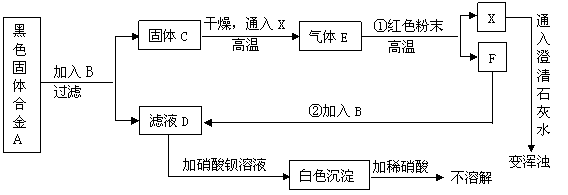
![]() 请回答下列问题:(化学方程式2分其它每空各1分)
请回答下列问题:(化学方程式2分其它每空各1分)
①A的主要成分是 (填化学式)。
![]() ②B是 (填化学式,下同)、D是 、E是 。
②B是 (填化学式,下同)、D是 、E是 。
③步骤①的化学反应方程式是 。
④步骤②的化学反应方程式是 。
该反应的基本反应类型是 。
⑤E在工业上可用于 。
四、实验(本题有2小题,共24分)
|
E |
|
D |
|
C |
|
B |
|
A |
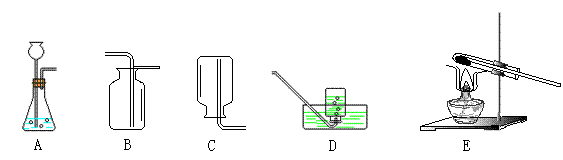 23.(12分)气体的制备是化学实验基本技能之一。现利用下列仪器进行实验,请回答:
23.(12分)气体的制备是化学实验基本技能之一。现利用下列仪器进行实验,请回答:
①利用A装置,通过置换反应能制得的气体是 ,该反应的化学方程式是
;(2分)其收集装置应选用 (填字母)。
②利用A装置,通过复分解反应能制得的气体是 ,该反应的化学方程式是
。(2分)
③A装置在加药品前,必须进行气密性的检查,其操作是
。(2分)
④将制得的氢气通入装有氧化铜粉末的E装置,加热,黑色粉末变红,说明氢气具有 性。
⑤由于氢气 ,可用作节日庆典气球的填充气。但由于氢气易燃易爆,所以在有氢气球的地方,最好放警示牌,请你写上一条警示语: 。
24.(12分)某课外活动小组通过Intnet网上资料得知:废弃的定影液中含有一定量的AgNO3。他们从摄影店收集到一些废弃的定影液,预备将其中的银以单质的形式全部回收。于是,他们进行了以下的实验活动:
(1)【设计方案】①加入比银活泼的金属单质 ②除去金属混合物中的杂质
(2)【小组讨论】
①选择加入的金属(化学方程式2分,下同)
甲同学认为:向定影液中加入过量的铜粉,则得到的金属混合物含有银和铜;
乙同学认为:向定影液中加入过量的铁粉,则得到的金属混合物含有银和铁。
你认为 同学的方案更合理,其原因是 ,该方案的化学方程式为: 。②除去银粉中混有的金属
向金属混合物中加入的试剂是 ,化学方程式为 。
|
加较活泼金属(过量) 操作a |
 (3)【进行实验】过程如下:
(3)【进行实验】过程如下:
①废弃定影液 金属混合物 溶液A
|
学校 班级 考号 姓名_________________试场号______________ 装订线内不要答题 u················装························订··················线············· |

|
加试剂(适量) 操作b |
 |
②金属混合物 Ag 溶液B
请回答:操作a是 ,需用到的玻璃仪器有:烧杯、玻璃棒和 ;溶液B中溶质的化学式为 。
(4)【产品验证】请你设计一种简单方法验证得到的银中是否还含有铁粉,方法是:
。(2分)
五、计算(10分)
25.(5分)1989年世界卫生组组织把铝列为食品污染源之一,每人每日的摄入量控制在0.004g以下。
若在1kg米南食品中加入明矾2g【明矾的化学式为:KAl(SO4)2·12H2O】请回答下列问题:
①人从食物中摄入的铝指的是 (填字母)。
A.铝元素 B.铝单质 C.铝合金 D.只有明矾
(2)明矾中各元素的质量比K:Al:S:O:H= ;铝元素的质量分数为(计算结果精确到0.1%) 。
(3)假如某人一天吃了100g上述米面食品,通过计算说明其摄入的铝的量是否超过安全摄入量。(2分)
26.(5分)
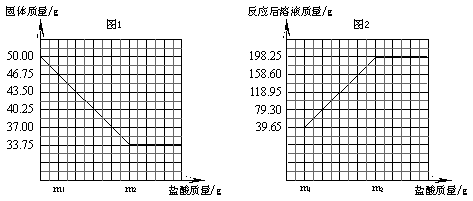 |
25.(8分)普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如下图。问:
(1)黄铜中Cu的质量分数。
(2)样品完全反应产生的H2的质量。
(3)稀盐酸的溶质质量分数。
参考答案
一、选择 BBBCB BBCCB BDAB
二、填空
15. 紫 红 蓝 酸碱
|
点燃 |
![]() 16.①2H ②2Cl2 ③H2S ④带3个单位下电荷的铁离子
16.①2H ②2Cl2 ③H2S ④带3个单位下电荷的铁离子
|
点燃 |
![]() 17.①N2 ②质量守恒定律
17.①N2 ②质量守恒定律
|
点燃 |
![]()
|
点燃 |
![]() 18.①C和H ②C2H5OH 3O2 2CO2 3H2O ③C
18.①C和H ②C2H5OH 3O2 2CO2 3H2O ③C
|
点燃 |
![]() 19.①小 ②160 ③C
19.①小 ②160 ③C
20.①白磷 ②4P 5O2 2P2O5 ③将温度降至白磷的着火点以下,隔绝白磷与空气接触
三、
21.①红色 无色 NaOH HCl=NaCl H2O ②< ③NaOH(或Na2CO3、NaHCO3)
④用熟石灰改良酸性土壤(或用氢氧化铝治疗胃酸过多等,合理答案给分)
|
高温 |
![]() 22.①C和Fe ②H2SO4 FeSO4 CO ③3CO Fe2O3 3CO2 2Fe
22.①C和Fe ②H2SO4 FeSO4 CO ③3CO Fe2O3 3CO2 2Fe
④Fe H2SO4=FeSO4 H2↑ 置换反应 ⑤冶炼金属(或燃料)
四、
23.①氢气 Zn H2SO4=ZnSO4 H2↑ ②二氧化碳 CaCO2 2HCl=CaCl2 H2O CO2↑
③在导管处套上带止水夹的橡皮管,然后在长劲漏斗中加入一定量的水至沐过漏斗下端,静置。若液面静止不动,则装置不漏气;反之,装置漏气。
④还原 ⑤气度比空气小 严禁烟火
24.(2)① 乙 铁粉比铜粉更易被除去(或更易得到、更经济)
(3)过滤 漏斗 FeCl2(或 FeSO4) ④用磁铁接触,看银粉是否被磁铁吸引(或取少量滴入稀盐酸或稀硫酸,看是不有气泡放出)
五、计算
25.(1)A (2)39:27:64:320:24 5.7%
(3) EQ \F(2g,1000g) ×100g=0.2g 0.2×5.7%=.00114g>0.004g 超过了安全摄入量
26.(1)67.5 % (2) 0.5 g (3) 10 %
| |